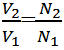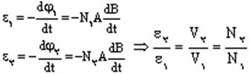|
آرشیو وبلاگ پیوندهای روزانه لوگو آمار وبلاگ
نابغه کوچولو جمعه 92 مرداد 18 :: 4:11 عصر :: نویسنده : نابغه
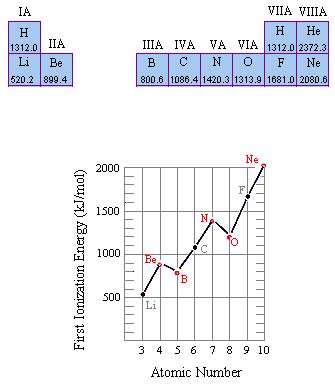
شکل 1 انرژی اولین یونش عناصر در ردیف دوم جدول تناوبی را نشان می دهد. اگرچه انرژی اولین یونش در حالت کلی با حرکت از چپ به راست جدول تناوبی افزایش دارد، اما در این الگو دو تناقض مشاهده می شود: انرژی اولین یونش بور از بریلیوم کوچک تر است و اکسیژن نیز اولین انرژی یونش کم تر از نیتروژن دارد.
شکل 1: مقادیر انرژی یونش بر حسب تغییرات عدد اتمی
این اثر می تواند با آرایش الکترون در این عناصر توضیح داده شود. زمانی که یک اتم بریلیوم یونیزه می شود، الکترون از اوربیتال 2s بیرون کشیده می شود، اما زمانی که اتم بور یونیزه می شود، الکترون اوربیتال 2p بیرون می آید:
Be: [He] 2s2 B: [He] 2s2 2p1
زمانی که نیتروژن و اکسیژن یونیزه می شوند، الکترون ها باز هم از اوربیتال 2p بیرون کشیده می شوند:
N: [He] 2s2 2p3 O: [He] 2s2 2p4
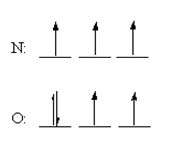
اما تفاوت مهمی در نحوه ی توزیع الکترون ها در این اتم ها وجود دارد. قاعده ی هوند پیش بینی می کند که هر 3 الکترون در اوربیتال 2p اتم نیتروژن، باید اسپین یکسانی داشته باشند اما در یک اتم اکسیژن، الکترون اضافی در یکی از اوربیتال های 2p جفت می شوند:
قاعده ی هوند می تواند از این فرض که الکترون ها سعی دارند تا حد ممکن از هم دور باشند تا نیروی دافعه ی بین این دو ذره، کم ترین مقدار را داشته باشد، بهتر درک شود. بنابراین، 3 الکترون در اوربیتال های 2p نیتروژن، وارد اوربیتال های متفاوتی می شوند و اسپین آن ها در جهت یکسانی قرار می گیرد. در اکسیژن، ابتدا 3 الکترون مانند حالت نیتروژن در اوربیتال های متفاوت قرار می گیرند ولی الکترون چهارم باید یکی از اوربیتال های 2p اشغال شده را انتخاب کند.
نیروی دافعه بین این دو الکترون، زمانی کم ترین مقدار را خواهد داشت که این دو الکترون در یکی از اوربیتال ها با هم جفت شوند. با این وجود، هنوز هم مقداری دافعه ی اضافی بین این دو الکترون وجود دارد که این عامل باعث می شود برداشتن یک الکترون از یک اتم خنثای اکسیژن، اندکی راحت تر باشد و این نتیجه با انتظار ما از مؤثر بودن تعداد پروتون های هسته ی اتم مطابقت ندارد. موضوع مطلب :  باور غلط : هوا تقریباً بیوزن است.
شاید شما هم باور ندارید که هوا وزن دارد، زیرا که تمام ما در درون هوا قرار داریم ولی یک مترمعکب از هوا در سطح دریا، در فشار متعارف و دمای صفر درجه سانتی گراد، وزنی برابر 2/1 کیلوگرم دارد.
این موضوع را می توانید با انجام آزمایش زیر مشاهده نمائید.
یک میله نازک فلزی نظیر میل بافتنی بر دارید. دو بادکنک یکسان را پر باد کنید و با نخ نازک آن ها را به دو انتهای میله فلزی، آویزان کنید. به وسط این میله نیز نخ دیگری ببندید و به کمک آن میله را به شاخه درخت یا چارچوب در و یا سقف بیاویزید.  نتیجه به یک ترازو شباهت خواهد داشت. در صورتی که تعادل در دو انتهای میله برقرار نباشد، با جا به جا کردن نقطه آویز یکی از بادکنک ها یا دادن تغییر جزیی در محل نخ وسط میله تعادل را مجدداً برقرار سازید. حال با یک سوزن باد یکی از بادکنک ها را خالی نمایید، بلافاصله متوجه خواهید شد که بادکنک مزبور بالا رفته و دیگری پایین می آید.
دلیل این آزمایش ساده را چنین توضیح می دهیم :هوا نیز مانند سایر اجسام دارای وزن است. البته در این آزمایش مطلب دیگری به نام نیروی ارشمیدس هوا هم موثر است، که فعلاً از آن صحبتی نمی کنیم.
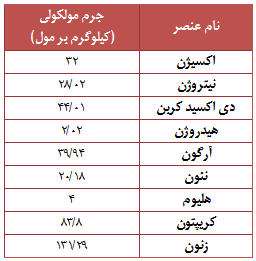
هوا بسیار سنگین تر از آنی است، که شما تصور می کنید، به طور میانگین وزن هوای اتاق بیشتر از 45 کیلوگرم می باشد. درست است که به دلیل بی رنگی عناصر هوای پاک، ما آن را مشاهده نمی کنیم ولی در واقع هوا نیز از موادی تشکیل شده است، که هر کدام از این مواد دارای جرم و وزن مخصوص خود هستند. به طور معمول ترکیبات موجود در هوا عبارتند از : 78 درصد نیتروژن (N2) درصد اکسیژن (O2) و 1 درصد دیگر عناصر مانند آرگون (Ar)، دی اکسید کربن (CO2)، متان (CH4) و هلیوم (He). بیشتر گازها از مولکول هایی تشکیل شده اند، که خود این مولکول ها نیز از ترکیب اتم هایی به وجود آمده اند. برخی از گازها نیز تنها به صورت اتمی وجود دارند.
هوایی که اطراف زمین را احاطه کرده است از میلیاردها میلیارد مولکول تشکیل شده است. پس مثل دیگر فازهای مواد مانند جامد و مایع که دارای وزن هستند، اکنون می دانید که هوا و دیگر مواد گازی شکل نیز دارای وزن مخصوص به خود هستند و وزن آن ها به وزن اتم ها و مولکول های تشکیل دهنده آن ها بستگی دارد.
جرم مولکلولی برخی مواد موجود در هوا را می توانید در جدول رو به رو مشاهده نمائید.
یک آزمایش دیگر نیز می تواند نشان دهنده وزن هوا برای شما باشد، برای این کار باید از یک ترازوی بسیار حساس مانند ترازوهایی که در طلافروشی از آن ها استفاده می شود، استفاده کنید.  ابتدا باید وزن یک بادکنک خالی را و مقداری نخ که می خواهید سر بادکنک را با آن ببندید را محاسبه کنید. سپس باید بادکنک را پر باد کنید و با آن مقدار نخی که وزن آن را به دست آورده اید، سر آن را محکم ببندید.
حال بار دیگر این بادکنک را وزن کنید و از عددی که مشاهده می کنید باید وزن نخ و بادکنک خالی را که در مرحله قبل به دست آورده بودید، را کم کنید تا وزن هوای محبوس در بادکنک را مشاهده کنید. موضوع مطلب : جمعه 92 مرداد 18 :: 4:7 عصر :: نویسنده : نابغه
 |
|
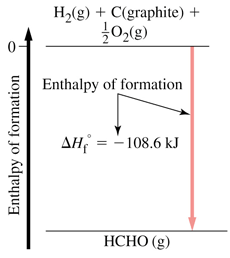
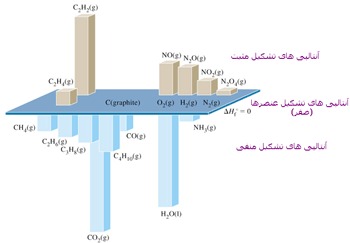
آنتالپی استاندارد مواد اکثراً منفی است. زیرا تشکیل مواد گرماده است.
 |
آنتالپی استاندارد سوختن
هنگامی که یک مول از ماده ای در مقدار کافی گاز اکسیژن خالص بسوزد، مقداری گرما آزاد می کند، به این مقدار گرما،آنتالپی استاندارد سوختن می گویند. معمولاً این کار در بمب کالری متری انجام می گیرد.
که آن را با 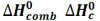 نشان می دهند.
نشان می دهند.
در زیر آنتالپی استاندارد سوختن چند ماده را می بینید.
C(graph) + 02(g) ---> CO2(g) H o c = - 394 kJmol-1 C2H6 + 3.5O2 --> 2CO2 + 3H2O H o c= -1560 kJ mol-1 C2H4 + 3O2 --> 2 CO2 +2 H2O H o c= -1409 kJ mol-1 C2H2 + 5/2 O2 --> 2 CO2 + H2O H o c= -1409 kJ mol-1
شعله استیلن داغ تر از اتیلن و شعله اتیلن داغ تر از اتان است. زیرا تعداد ملکول تشکیل شده در استیلن کمتر از اتیلن و اتیلن کمتر از اتان است.
آنتالپی استاندارد تبخیر
تغییر آنتالپی مربوط به تبخیر یک مول از ماده ای در نقطه جوش خود، آنتالپی تبخیر نامیده می شود که آن را با 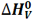 نمایش می دهیم.
نمایش می دهیم.
برای تبخیر یک مول آب 1/41 کیلوژول گرما نیاز است.
H2O(l) + 41.1 KJ ---> H2O(g) H o v [H2O(l)] = 41.1 KJ/mol
آنتالپی استاندارد ذوب
تغییر آنتالپی مربوط به ذوب یک مول از ماده ای در نقطه ذوب خود، آنتالپی استاندارد ذوب نامیده می شود که آن را با 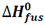 نمایش می دهیم.
نمایش می دهیم.
H2O(s) + 6.0 KJ ---> H2O(l) Hfus0[H2O(l)] = 6.0 KJ/mol
که همان گرمای نهان ذوب است.
در هنگام ذوب شدن یک ماده، تنها باید بتوان کمی پیوندهای بین گونه ها (اتم، مولکول یا یون) را سست کرد تا گونه ها بتوانند در حالت مایع، آزادی بیشتری داشته باشند.
اما در هنگام تبخیر، باید گونه ها بتوانند خود را به طور کامل از پیوندهای موجود برهانند و از محلول خارج شده به سمت بالا بروند. از این رو دو انرژی یکی برای غلبه کامل بر پیوندهای موجود و گسستن کامل آن ها و دوم انرزی برای غلبه بر شتاب گرانش و رفتن به سمت بالا نیاز دارند. به همین دلیل همواره گرما و انرژی بیشتری برای تبخیر مورد نیاز است یا به بیانی دیگر آنتالپی تبخیر برای یک ماده خاص همواره بیشتر از آنتالپی ذوب می باشد.

آنتالپی استاندارد تصعید
به تغییر آنتالپی واکنش مربوط به تصعید یک مول از ماده، آنتالپی استاندارد تصعید می گویند و آن را با 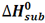 نمایش می دهند.
نمایش می دهند.
NH4Cl ---> HCl + NH3 CO2(s) ----> CO2(g) Hsub0 = 25 KJ/mol
شکل زیر یخ خشک را نشان می دهد که درحال تصعید (فرازش) است. عکس عمل تصعید، چگالش نامیده می شود.

متوسط آنتالپی پیوند
برای شکستن پیوند کووالانسی باید انرژی صرف شود و هنگام تشکیل پیوند، انرژی آزاد می شود. ارقام بسیاری از انرژی های پیوندی، متوسط هستند. زیرا مقدار انرژی لازم برای شکستن آن پیوند در یک ملکول متفاوت است. مثلاً برای شکستن پیوند های C-H در CH4 انرژی لازم برای شکستن اولین پیوند C-H با دومی و با سومس و سومی با چهارمی متفاوت است. برای مثال پیوند O-H در ملکول H-O-H دارای انرژی تفکیک 4/493 کیلوژول بر مول است درحالی که برای شکستن پیوند O-H دوم خود نیازمند 4/424 کیلو ژول بر مول انرژی است که مقدار متوسط آن 9/458 کیلو ژول بر مول می باشد.
برای متان مقادیر انرژی تفکیک پیوند های C-H به ترتیب برابر:
435، 444، 444، 339 کیلوژول بر مول انرژی برای جدا کردن اولین، دومین، سومین و چهارمین پیوند لازم است که متوسط آن 415 کیلوژول بر مول است.
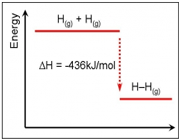
تشکیل H2
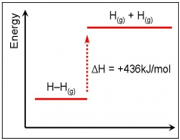
تفکیک H2
موضوع مطلب :
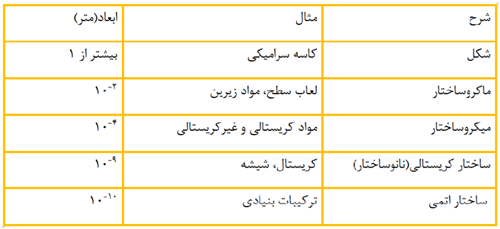
شکل یک جسم، وظیفه و عملکرد آن را منعکس می کند. چنانچه تفاوت شکل یک ظرف با شکل یک تیغه منجر به تفاوت در کارایی و کاربرد این دو می شود. چیزی که باعث تفاوت در رفتار این دو ماده می شود ساختاری است که با چشم قابل مشاهده است. به چنبن ساختاری ماکرو ساختار اطلاق می شود. هر ظرف ممکن است متخلخل باشد یا لعاب داشته باشد. این تخلخل مربوط به مقیاس ماکرو است.

شکل1-ساختار ماکرومتری
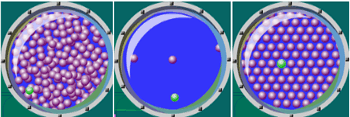
ماده خواص دیگری هم در ابعاد حجیم دارد که بسیاری از آن ها قابل اندازه گیری هستند اما مشاهده نمی شوند. این خواص در محدوده ساختاری به نام میکرو ایجاد می شوند. میکرو ساختار در مقیاسی بین میلیمتر و میکرومتر قرار دارد. شکل زیر مربوط به یک شبیه سازی از ابعاد میکروساختار ماده است.
 |
شکل2-میکروساختار
اما ابعاد میکرومتری انتهای کار نیستند و ابعاد بنیادی تر و ریزتری هم وجود دارد. در حال حاضر تراشه های جدید در مقیاس خیلی کمتری نسبت به میکرومتر طراحی می شوند.
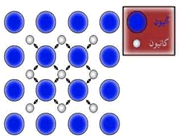
در ابعاد زیر میکرومتری با ساختارهای متشکل از صدها و هزاران اتم روبه رو هستیم که نانوساختار ماده شناخته می شوند. ساختاری متشکل از اتم ها که به مراتب در سطحی بنیادی تری از ماکرو و میکروساختار ها قرار دارد. در نانوساختار، نوع اتم ها، موقعیت و تعداد و نحوه آرایش آن ها مورد توجه قرار می گیرد.
 |
شکل3-نانوساختار ماده
علاوه بر ساختارهای نانو تا ماکرو ساختار جداگانه ای نیز در سطح ماده ایجاد می شود که وضعیت آن کمی با داخل جسم جامد متفاوت است. اگر اتم های متفاوتی ساختار کریستال را بسازند، سطوح بیرونی در این کریستال شامل چند نوع اتم هستند.
به دلیل قطع پیوند این اتم ها, سطح ماده دارای ابری از الکترون ها است که در اوربیتال های الکترونی در سطح بیرونی ماده هستند. این الکترون ها فعالیت و واکنش پذیری را زیاد خواهند کرد. سطوح خارجی، قلب بسیاری از فرآیندهای شیمیایی مانند فعالیت های کاتالیستی و خوردگی هستند که نقش مهمی در کار بسیاری از ابزارهای الکترونیکی و شیمیایی ایفا می کنند. اخیراً تلاش های زیادی شده است که ابزارهایی نزدیک به مقیاس اتمی به اندازه ای کوچکتر از 10 نانو متر بسازند. این کار در محدوده کار فناوری نانو قرار می گیرد.
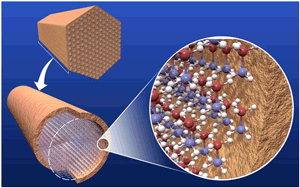 |
شکل4: ساختار سطحی (Surface Structure)
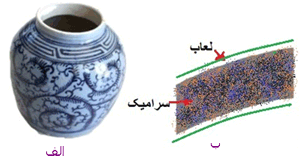 |
شکل5: ساختار و مقیاس(الف)شکل یک کاسه چینی (ب) ماکروساختار کاسه شامل سطح لعاب و بدنه سرامیکی
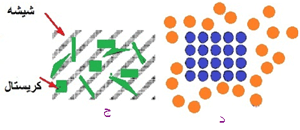 |
(ج) میکروساختار سرامیک شامل ذرات کریستال در یک محیط شیشه ای
(د)نانوساختار سرامیک شامل چیدمان اتمها که در کریستال به صورت منظم و در بخش شیشه ای سرامیک به طور نامنظم می باشند
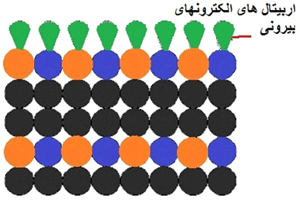 |
ساختار سطحی شامل اتم های مختلف مجاور سطح و اوربیتال های الکترونی نیمه پر
موضوع مطلب :

غروب سرخ فام زیبا با آن همه رنگ های بهم آمیخته و موّاجش، یکی از دلپذیر ترین مناظر طبیعی است. به هنگام تماشای این منظره شاید هم به خود گفته باشیم :« اوه، خورشید چه قرمز شده!!»
البته باید بدانیم که این خود خورشید نیست که هنگام غروب، قرمز می شود . بلکه این تنها نظر ماست که در آن لحظه ی خاص، خورشید را بدین گونه جلوه گر می یابیم.
آری، درست در همان لحظه ای که خورشید به نظر ما قرمز رنگ می آید، مردمی که هزاران فرسنگ در جهت غرب از ما دورند، هرگز آن را به این رنگ نمی بینند.
تنها چیزی که به هنگام غروب فرق کرده و باعث رنگ قرمز خورشید شده مسافتی است که نور آفتاب باید آن را در داخل اتمسفر یا جوّ زمین بپیماید. هر اندازه که خورشید از افق پایین تر می رود، مقدار مسافتی را که نور در جوّ می پیماید، بیشتر می شود.
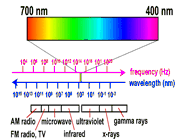
اکنون به خاطر آوریم که نور آفتاب ترکیبی از نور های رنگارنگ است.
نور آفتاب به طور عادی به نظر ما سفید جلوه می کند ولی چون جوّ زمین، یعنی هوای گرداگرد آن از ذرات هوا، غبار، بخار آب و سایر اجسام ناخالص مملوّ، است، از این رو نوری که از آن عبور می کند، به وسیله ی این ذرات به رنگ های گوناگونی منعکس می شود.
اتمسفر یا جوّ زمین به گونه ای است که نور بنفش، آبی و سبز را بیشتر از نور قرمز و زرد منتشر می کند. از این رو چون خورشید در افق رو به پایین می رود، جوّ زمین رنگ های قرمز و زرد را بیشتر در خود نگه داشته و بیشتر آن ها را به دید ما می آورد. پس به همین دلیل است که افق هنگام غروب به رنگ قرمز جلوه گر می شود.

در ضمن، همین سیستم خاص نورافشانی که در جوّ زمین وجود دارد، برای ما مطلب دیگری را نیز روشن می سازد و آن این که چرا ما آسمان را به رنگ آبی می بینیم ؟ نور بنفش و آبی دارای امواجی کوتاه هستند. یعنی حدود ده مرتبه سریع تر از امواج نور قرمز در جو زمین پخش می شوند. این نکته نشان دهنده این است که اشعه ی قرمز خود به طور مستقیم در جو زمین حرکت می کنند، ولی امواج آبی باید به وسیله ی ذرات هوا ، آب و غبار پخش گردند پس وقتی که ما سر به آسمان بلند می کنیم ، در حقیقت امواجی را می بینیم که بدین گونه پخش شده اند. آنگاه از همین رو است که آسمان به نظر مان آبی رنگ می نماید.
دیدیم که دلیل رنگ قرمز خورشید و رنگ آبی آسمان، مسافتی است که نور طی می کند تا به چشم ما می رسد (البته وجود گرد و غبار در جو نیز مهم است) اما دلیل رنگ کمان به پدیده شکست نور مربوط می شود.
رنگینکمان، همانگونه که از نامش پیداست، کمانی متشکل از چند رنگ است. اگر هنگام بارش باران، خورشید در آسمان ظاهر شود، رنگینکمان به وجود میآید. نور خورشید، که ما آن را معمولاً سفید میبینیم، ترکیبی از هفت رنگ مختلف است. این هفت رنگ عبارتاند از: بنفش، نیلی، آبی، سبز، زرد، نارنجی و قرمز. به این ترتیب اگر نور خورشید تجزیه شود، نواری متشکل از هفت رنگ پدیدار میشود که به آن «طیف» میگویند.

رنگینکمان معمولاً بعد از بارش باران، یعنی زمانی که هوا پر از قطرات ریز آب است، ظاهر میشود. در واقع هرکدام از این قطرات مانند یک منشور کوچک عمل میکنند. نور خورشید پس از عبور از میان قطرات باران میشکند و به هفت رنگ تشکیلدهنده خود تجزیه میشود. هر جزء تشکیلدهنده نور خورشید با زاویه شکست مخصوص به خود میشکند. به همین دلیل ما آن ها را به هفت رنگ مختلف میبینیم.
معمولاً یک رنگینکمان کامل دو کمان اصلی و ثانویه دارد. کمان اصلی پررنگتر و درخشان تر از کمان ثانویه است. در رنگینکمان اصلی ترتیب قرار گرفتن رنگ ها از بالا به پایین عبارت است از: قرمز، نارنجی، زرد، سبز، آبی، نیلی و بنفش. ترتیب قرار گرفتن رنگ ها در کمان ثانویه عکس کمان اصلی است؛ یعنی بنفش بالاترین و قرمز پایینترین رنگ است. کمان ثانویه بالای کمان اصلی شکل میگیرد. در واقع این کمان در اثر شکسته شدن مجدّد پرتوهای نور به وجود میآید.
موضوع مطلب :
وقتی سطح انرژی فرآورده ها از واکنش دهنده ها بالاتر است، واکنش گرما گیر است.
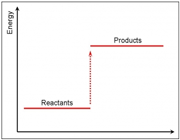
اگر سطح انرزی فرآورده ها پایین تر از مواد اولیه باشد، واکنش گرماده است.
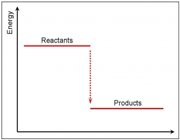


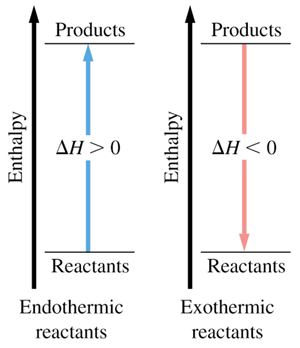
چون اکثر واکنش های شیمیایی در فشار ثابت روی می دهند. تغییر انرژی آن ها همراه با انجام کار توسط سامانه روی محیط یا برعکس است. همواره میزان آنتالپی با انرژی درونی متفاوت است. آنتالپی تغییر انرژی یک سامانه در فشار ثابت است. بنابراین تغییر انرژی واکنش های گرمازا را با آنتالپی منفی و واکنش های گرما گیر را با انتالپی مثبت نمایش می دهیم.
dH = Hfinal – Hinitial
 |
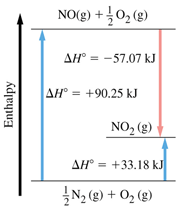
آنتالپی مانند انرژی درونی یک تابع حالت است و اختلاف حالت اولیه آنتالپی با حالت نهایی آن در واکنش شیمیایی، آنتالپی واکنش نامیده می شود و به مسیر واکنش بستگی ندارد. درشکل زیر واکنش از هر روشی صورت گیرد، آنتالپی واکنش 33.18 کیلوژول است.
C8H18(g) +15/2 O2(g) --> 8CO2(g) + 9H2O(g) DH = -5470.5 kJ mol-1
واکنش سوختن اکتان گرما زا است. یعنی 5470.5 کیلوژول بر مول گرما آزاد می شود و علامت منفی است. اما واکنش زیر یک واکنش گرما گیر است و برای انجام شدن نیازمند 11.3 کیلوژول بر مول گرما است.
2HI(g) --> H2(g) + I2(g) DH = + 11.3 kJ mol-1
وقتی یخ را گرم کنیم دمای آن بالا می رود تا به صفر درجه برسد. در صفر درجه آب و یخ در حال تعادل هستند. در این حالت افزایش گرما سبب افزایش دما نمی شود. بلکه صرف ذوب شدن یخ می گردد که چون انرژی جذب می شود، تغییر آنتالپی مثبت می باشد.
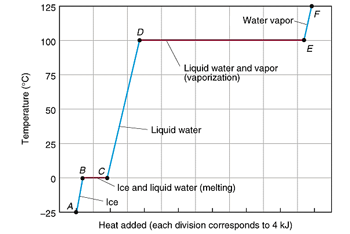
در دمای صفر درجه چون گرمای اضافه شده صرف ذوب شدن گردیده، افزایش دما نداریم. اما آنتالپی افزایش یافته است. همین وضعیت در نقطه جوش نیز دیده می شود.
بنابراین تبدیل آب مایع به گاز یک فرآیند گرماده است و تبدیل آب جامد به مایع یک فرآیند گرماگیر است.
این وضعیت در تبدیل مایع و گاز و گاز به مایع هم داریم.
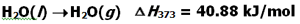
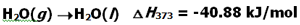
واکنش کلسیم اکسید با آب یک واکنش گرماده است.
واکنش آمونیوم نیترات با آب یک نمونه از فرآیندهای خود به خودی است که در بسته های خنک کننده تجارتی از آن یا آمونیوم کلرید استفاده می شود. در این بسته ها مقدار کمی از این نمک ها به کمک یک غشاء نازک از آب جدا شده اند. وقتی این بسته لمس می شود. غشاء پاره شده و نمک در آب حل می شود. چون این واکنش گرما گیر است. گرما را از محیط جذب کرده و دستان شما خنک می شود.
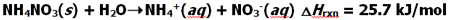
موضوع مطلب :

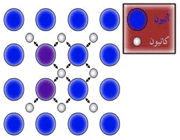
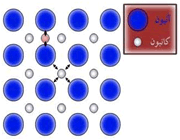
طی سال های گذشته و هم زمان با پیشرفت هایی که در زمینه استفاده از انرژی هسته ای صورت گرفته است، مجموعه ای از مفاهیم و عبارات نیز وارد زبان روزمره فارسی شده که اگر چه بارها در رسانه ها شنیده می شوند، اما برخی از آن ها برایمان شفافیت چندانی ندارند. یکی از این عبارات"سانتریفیوژ" است.
شاید ساده ترین نوع استفاده از این تکنیک، ریختن سبزی های شسته شده در سبدی مخصوص و چرخاندن آن با استفاده از دستگیره و خارج نمودن آب اضافی از آن ها باشد.
بررسی این فرایند در نوع خود کار ساده ای است. آزمایشی ساده می تواند بسیاری از علامت ها پرسش ها را از میان بردارد:
سطل آبی را برداشته و در حالی که تا نیمه پر از آب است، با سرعت به دور خود چرخانده و پس از چند دور پرتاب کنید. به خوبی دیده می شود که به واسطه نیروی گریز از مرکز ایجاد شده، آب درون سطل از آن بیرون نمی ریزد. این امر، پایه و اساس سیستم های سانتریفیوژ به حساب می آید.
در یک سانتریفیوژ واقعی نیز فرایند مشابهی روی می دهد. به واسطه ی چرخش بسیار سریع محفظه ای به دور خو دش، هر آن چه در درون آن وجود دارد به سمت بیرون تحت فشار قرار می گیرد.
این دستگاه می تواند در بر گیرنده هر ماده ای باشد، از نمونه های خونی گرفته تا مواد شیمیایی مختلف از این رو نمونه های آن بسیار متنوع است.

به عنوان مثال:
ناسا دارای سانتریفیوژ عظیمی است که از آن برای قرار دادن فضا نوردان در معرض نیروهای شدید استفاده می شود.
نیروی گریز از مرکز تولید شده در این سانتریفیوژ می تواند شبیه سازی بسیار مناسبی از نیروی گرانشی باشد که در زمان پرتاب فضاپیماها بر بدن هوا نوردان وارد می شود.
هم چنین در فرایند تولید سوخت هسته ای و استفاده از آن در نیروگاه ها، که با هدف تولید انرژی نظیر الکتریسته صورت می گیرد، سانتریفیوژها نقش اساسی را در غنی سازی اورانیوم ایفا می کنند، به طوری که در صورت نبود آن ها عملا مانع بزرگی بر سر راه غنی سازی اورانیوم به وجود می آید.
البته روش های مختلفی برای این کار وجود دارد ، اما بررسی ها نشان داده اند که استفاده از سانتریفیوژ بهترین و موثرترین روش برای غنی سازی اورانیوم است.
موضوع مطلب :

به گزارش خبرنگار باشگاه خبرنگاران مرکز فارس، دانشجوی کارشناسی ارشد ارگونومی دانشگاه علوم پزشکی شیراز در مورد رنگ کربن فریت جاذب امواج موبایل گفت: ارائهدهنده این ایده خودم بودم که در گروه فیزیک پزشکی دانشگاه علوم پزشکی شیراز مطرح و با راهنمایی استاد محمد مهدی موحدی ساخته شد.
ناصر دهقان افزود: خانههایی که نزدیک آنتنهای bts موبایل باشند در معرض تشعشعات زیانآور امواج این آنتنها هستند بنابراین با ساخت این رنگ و استفاده آن بر روی دیوارهای منازل نزدیک این آنتنها میتوان از نفوذ تششعات آنها جلوگیری کرد.
به گفته وی، مزایای رنگ جاذب امواج الکترومغناطیسی موبایل و آنتنهای BTS، میتواند در تضعیف مناسب امواج الکترومغناطیسی بسیار موفق عمل کند و هزینه ساخت پایینی دارد.
دهقان افزود: از این ماده میتوان به عنوان حفاظ در دیوارهای اتاقهای MRI بیمارستان یا در اتاقهای برج مراقبت پروازی فرودگاهها استفاده کرد.
این اختراع به شماره 038595 الف/89 در سازمان ثبت اسناد و املاک کشور به ثبت رسیده است.
موضوع مطلب :
- آیا داروها زنانه و مردانه دارند؟
- حقایقی مهم در مورد قند میوه ها ( فروکتوز )
- دستهایتان چه شکلی هستند؟ + روان شناسی دستها
- رژیم غذایی دوپامین چیست و چگونه کار می کند
- کم خوابی می تواند این عوارض مرگبار را داشته باشد
- شخصیت شناسی از روی رنگ چشم ها
- این اشتباهات را در مورد زیبایی پوست, مو و دندان تان انجام می دهی
- هشدار های زبان شما در باره سلامتی شما
- با خلق و خوی آقایان در ساعات مختلف روز آشنا شوید
- تشخیص ابتلا به بیماری قلبی با توجه به سرعت راه رفتن شما!
- لیست آخرین مطالب