|
آرشیو وبلاگ پیوندهای روزانه لوگو آمار وبلاگ
نابغه کوچولو پنج شنبه 92 مرداد 17 :: 1:40 عصر :: نویسنده : نابغه
برای فهم بهتر این مطلب، مطالعه ی مطالب اسید و باز توصیه می شود.
بازهای لوئیس: بهتر است این رابطه را با این نظر شروع کنیم که بازهای برونشتد- لوری زمانی که یون های هیدروژن می پذیرند، چه کاری انجام می دهند؟ در این جا سه باز برونستد - لوری آمونیاک، آب و یون هیدروکسید را بررسی کرده و وضعیت برای بقیه ی بازها نیز به همین ترتیب است.
نظریه ی اسید و باز برونشتد- لوری می گوید: این مواد (آمونیاک، آب و یون هیدروکسید) نقش بازی دارند زیرا با یون هیدروژن ترکیب می شوند. دلیل ترکیب آن ها با یون هیدروژن آن است که همگی جفت الکترون تنها دارند و این همان چیزی است که نظریه ی اسید و باز لوئیس نیز به آن اشاره کرده است. تا این قسمت، این دو نظریه کاملاً با هم سازگاری دارند.
در نگاه اول، چیزی به نظر نمی رسد و این دو نظریه فقط از دو زاویه ی متفاوت به مفاهیم اسید و باز پرداخته اند. اما در مورد دیگر واکنش های آب و آمونیاک نیز وضعیت به همین ترتیب است؟
در نظریه ی لوئیس، هر واکنشی که در آن آمونیاک یا آب، جفت الکترون های تنهای خود را برای تشکیل پیوند کوئوردینانسی استفاده کرده اند، آن ها را به عنوان باز معرفی خواهد نمود.  حال واکنشی را بررسی می کنیم . و بهتر است مطلب مربوط به پیوند کوئوردینانسی را نیز قبل از آن مطالعه کنید... آمونیاک با BF3 واکنش می دهد و از جفت الکترون تنهای خود استفاده می کند تا یک پیوند کوئوردینانسی با اوربیتال خالی بور (B) تشکیل دهد.
تا آن جا که آمونیاک درگیر واکنش است، دقیقاً همانند وقتی رفتار می کند که با یون هیدروژن واکنش می دهد (یعنی در این مورد هم با استفاده از جفت الکترون تنهای خود، پیوند کوئوردینانسی با یون هیدروژن تشکیل می دهد). بنابراین اگر قصد دارید آمونیاک را در این بحث به عنوان باز در نظر بگیرید، در موارد دیگر هم به عنوان باز خواهد بود.
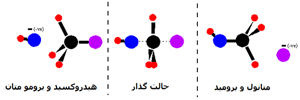
اسیدهای لوئیس: اسید های لوئیس، پذیرنده های جفت الکترون هستند. در مثال قبل، BF3 با پذیرفتن جفت الکترونتنهای نیتروژن، نقش اسید لوئیس را دارد. در نظریه ی برونشتد- لوری، BF3 ابداً خاصیت اسیدی ندارد. سؤال:در مورد واکنش های اسید و باز دیگر (برای مثال، واکنش بین آمونیاک و گاز کلرید هیدروژن) وضعیت چگونه است؟ (NH3(g) + HCl (g) ........ NH4+(s) + Cl- (s چه چیزی دقیقاً جفت الکترونتنهای روی نیتروژن را می پذیرد؟ اغلب کتاب ها این مطلب را طوری می نویسند که گویی آمونیاک جفت الکترون تنهای خود را به یون هیدروژن می دهد (یک پروتون تنها بدون هیچ الکترونی در اطراف آن). این نظرات گمراه کننده اند معمولاً نمی توان یون هیدروژن آزادی در سیستم های شیمیایی به دست آورد.
این یون ها به قدری واکنش پذیرند که همیشه به ساختار دیگری متصل می شوند. اما . . . هیچ یون هیدروژن ترکیب نشده ای در HCl وجود ندارد.
از طرفی، در HCl اوربیتال خالی وجود ندارد که بتواند یک جفت الکترون بپذیرد. پس با این حساب آیا HCl یک اسید لوئیس است؟ کلر الکترونگاتیوتر از هیدروژن است و این به معنای آن است که کلرید هیدروژن یک مولکول قطبی خواهد بود. الکترون ها در پیوند کلر- هیدروژن به سمت کلر جذب خواهند شد و مختصری آن را منفی خواهند کرد و هیدروژن را با اندکی بار مثبت تنها خواهند گذاشت.  جفت الکترون تنها روی نیتروژن در مولکول آمونیاک به سمت اتم هیدروژن مولکول HCl با اندکی بار مثبت، جذب می شوند. هر چه این الکترون ها نزدیک می شوند، الکترون های پیوند کلر- هیدروژن باز هم به سمت کلر رانده می شوند. در نهایت، یک پیوند کوئوردینانسی بین نیتروژن و هیدروژن تشکیل می شود و کلر به صورت یون کلر جدا می شود. این مطلب با استفاده از " نمادگذاری خمیده" که معمولاً در مکانیسم های واکنشی آلی مورد استفاده قرار می گیرد، بهتر فهمیده می شود: 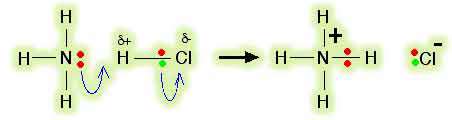 کل مولکول HCl نقش اسید لوئیس را دارد و یک جفت الکترون از آمونیاک می پذیرد و در حین واکنش، تفکیک می شود. اسیدهای لوئیس الزاماً مجبور نیستند اوربیتال خالی آماده داشته باشند.
موضوع مطلب : چهارشنبه 92 مرداد 16 :: 7:4 عصر :: نویسنده : نابغه
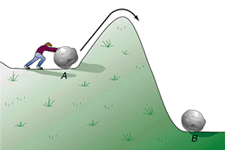
نظریه ی حالت گذار پیشنهاد می کند هنگامی که مولکول های واکنش دهنده به نزدیکی همدیگر می رسند، به طور آنی در حالتی با پایداری کم تر از پایداری حالت واکنش دهنده ها و محصولات خواهند بود.
در نظریه ی حالت گذار، مکانیسم اندرکنش واکنش دهنده ها مطرح نیست؛ معیار مهم آن است که مولکول های واکنش دهنده، انرژی کافی برای غلبه بر سد پتانسیل انرژی (انرژی فعال سازی) داشته باشند تا واکنش دهند.
در این حالت با پایداری کم تر، اتمها خود را از نو آرایش می دهند، پیوندهای اصلی ضعیف می شوند و پیوندهای جدید اندکی تشکیل می شوند.
انرژی پتانسیل سیستم در این نقطه افزایش می یابد؛ زیرا:
· مولکول های واکنش دهند هی در حال واکنش، باید به نیروهای دافعه ی متقابل بین الکترون های لایه ی بیرونی تر اتم های سازنده ی خود غلبه کنند. · اتم ها باید هنگام شکسته شدن پیوندهایشان از هم جدا شوند.
برای یک واکنش دو مولکولی، حالت گذار هنگامی تشکیل می شود که پیوندهای مولکول های قدیمی، ضعیف می شوند و پیوندهای جدید شروع به شکل گیری می کنند یا این که ابتدا پیوندهای قدیمی می شکنند تا حالت گذار را شکل دهند و بعد از آن پیوندهای تازه تشکیل می شوند.
در مثال زیر، حالت گذار اتفاق می افتد:
رسیدن به حالت گذار، انرژی زیادی لازم دارد؛ بنابراین این حالت، مادهای با انرژی زیاد به وجود میآید. این افزایش در انرژی پتانسیل با سد پتانسیلی متناظر است که اگر واکنش به پیش رود، مولکولهای واکنشدهنده باید از آن عبور کنند.
آرایش اتمها در بیشینهی این سد پتانسیل، کمپلکس فعال یا حالت گذار نامیده میشود و یک حالت واسطهی گذرا بین واکنشدهندهها و محصولات است. · حالت گذار یا کمپلکس فعال شده، یک حالت ترکیبی ناپایدار گذرای مولکولهای واکنشدهنده است که در یک بیشینهی انرژی پتانسیل اتفاق میافتد. این ترکیب هم می تواند در جهت تولید محصولات به پیش رود و هم به سمت واکنش دهندههای تغییر نیافته برگردد. · تفاوت انرژی بین واکنش دهنده ها و بیشینه ی انرژی پتانسیل به انرژی فعال سازی برمی گردد.
حرکت واکنش از روی بیشینهی انرژی پتانسیل اغلب با دیاگرام هماهنگ واکنش نشان داده می شود.
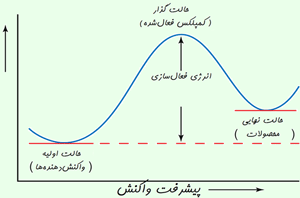
افزایش در انرژی پتانسیل با سد پتانسیلی متناظر است که اگر واکنش به پیش رود، مولکولهای واکنشدهنده باید از آن عبور کنند.

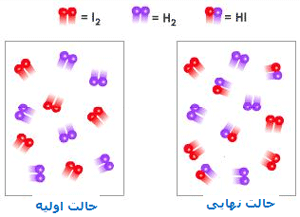
شکلهای زیر، نظریهی حالت گذار را با اشاره به واکنش بین هیدروژن و ید برای تولید یدید هیدروژن نشان میدهد:
 در این فرایند، مولکول های واکنشدهنده به همدیگر نزدیک میشوند و زمانی که آن ها در حین متعادلسازی واکنش برای حالت گذار یا کمپلکس فعالشده به پیش میروند:
 پیوندهای اصلی ضعیف میشوند.  پیوندهای جدید نسبتاً تشکیل میشوند.
در این شکل، واکنش در حهت تولید محصول پیشرفت میکند. این شکلها را به دقت نگاه کنید تا ضعیف شدن پیوندهای اصلی و تشکیل پیوندهای جدید را بعد از تولید محصولات ببینید:
همان طور که دما افزایش پیدا می کند، سهم اجزای واکنش دهندهای که می توانند به بیشینه ی انرژی پتانسیل برسند، افزایش پیدا می کند؛ افزایش تعداد مولکول ها ی محصول که در هر ثانیه تشکیل می شوند، آهنگ واکنش را افزایش می دهد.  نکات کلیدی:
 افزایش دمایی مانند 10 K آهنگ واکنش بسیاری از واکنش های شیمیایی را تقریباً دو برابر می کند. افزایش دمایی مانند 10 K آهنگ واکنش بسیاری از واکنش های شیمیایی را تقریباً دو برابر می کند. نظریه ی برخورد بر پایه ی انرژی جنبشی است و فرض میکند که ذرات باید دارای دو شرط جهت مناسب و انرژی جنبشی کافی باشند تا واکنش دهنده ها به محصول تبدیل شوند.
 کم ترین انرژی جنبشی لازم برای یک برخورد توسط مولکول های واکنش دهنده برای تشکیل محصولات، انرژی فعال سازی (Ea) نامیده میشود.  نسبت مولکول های واکنش دهنده ای که با انرژی جنبشی مساوی با انرژی فعال سازی واکنش می دهند، با افزایش دما زیاد می شود.
 نظریه ی حالت گذار پیشنهاد می کند که هنگام نزدیک شدن مولکول های واکنش دهنده، یک کمپلکس فعال شده ی گذرا (حالت گذار) در بیشینه ی انرژی پتانسیل تشکیل می شود.  در نظریه ی حالت گذار، انرژی فعال سازی، تفاوت انرژی بین واکنش دهنده ها و بیشینه ی انرژی پتانسیل است.
 در کمپلکس فعالشده، پیوندهای اصلی ضعیف شده و پیوندهای جدید نسبتاً تشکیل میشوند. کمپلکس فعالشده ممکن است در جهت تولید محصولات به پیش رود و یا به سمت واکنشدهندهها برگردد.  زمانی که دما افزایش پیدا می کند، نسبت بزرگ تری از مولکول های واکنش دهنده می تواند به بیشینه ی انرژی پتانسیل رسیده و کمپلکس فعال شده تشکیل دهند. بنابراین تعداد مولکول های محصول تشکیل شده در هر ثانیه افزایش پیدا می کند. موضوع مطلب : چهارشنبه 92 مرداد 16 :: 7:2 عصر :: نویسنده : نابغه

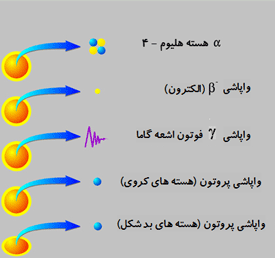
مواد رادیواکتیو از اتم های ناپایداری تشکیل شده اند که به طور متوالی تجزیه شده و انرژی سطح بالایی به نام تابش رادیواکتیو را آزاد می کنند. این اتم ها نهایتا عناصر جدیدی را تشکیل می دهند. طی این تجزیه و واپاشی، ذرات یا اشعه هایی از اتم ها ساتع می شود که سه نوع اند: ذرات آلفا ، ذرات بتا ، و پرتوهای گاما.
اطلاعات اولیه:
تاریخچه: حدود اواخر قرن نوزدهم اکثر دانشمندان بر این عقیده بودند که تمام مسائل عمده فیزیک به غیر از چند مورد جزئی که برای قطعیت دادن به برخی نظریه های ضروری بود، حل شده است. در سال 1895 ، رنتگن اشعه ایکس را کشف کرد. این اشعه نخست در معاینات پزشکی به کار رفت و بعدها برای بررسی ساختمان اساسی مواد مورد استفاده قرار گرفت. چند ماه بعد ماری کوری این پدیده جدید را رادیو اکتیو نامید. او و همسرش پیر کوری علاوه بر این ، پولونیم (po ، فلز ضعیف) و رادیم (Ra ، فلز قلیایی خاکی قوی) را کشف کردند. ماری کوری نخستین کسی بود که از اصطلاح «رادیواکتیو» برای موادی که فعالیت الکترومغناطیسی قابل توجه دارند، استفاده کرد. خاصیت رادیواکتیویته این دو عنصر جدید از اورانیم بیش تر بود.
سیر تحولی و رشد:  ماری کوری تحقیق خود را با جستجو در کاربردهای پزشکی رادیواکتیو ادامه داد. و قدرت تشعشع ترکیبات اورانیم را اندازه گرفت و تحقیق خود را به عناصر دیگر از جمله توریوم ، گسترش داد. ماری و پیر کوری همراه با فیزیک دان فرانسوی هنری بکرل (1908-1852 میلادی) مدل دیوی انجمن سلطنتی انگلستان و جایزه نوبل فیزیک را برای کشف رادیواکتیو دریافت دریافت کردند. پیر کوری کشف کرد که رادیم (Ra) خود به خود حرارت آزاد می کند. این خاصیت، ویژگی اثبات شده ای از انرژی اتمی به شکل گرماست.
برای همین نیز در سال 1910 میلادی در کنفرانس بروکسل در مورد رادیواکتیویته ، واحد رادیواکتیویته به افتخار او کوری نامیده شد. در مورد کشف رادیواکتیویته توسط هانری بکرل باید بگوییم که در سال 1896 میلادی ، بکرل در جستجوی شواهدی بود که ثابت کند مواد شیمیایی که نور طبیعی فلوئورسان دارند، از خود پرتو ساطع می کنند. او یک نمونه سولفات پتاسیم اورانیم را برداشت و آن را همراه با یک صفحه عکاسی در کاغذ سیاه پیچید. از آن جا که روزی ابری بود. نمونه بکرل خاصیت فلوئورسانی را از خود نشان نمی داد. او آن را درکشویی در آزمایشگاه خود گذاشت و به آزمایش های خود در مورد لامپ های اشعه کاتدی ادامه داد.
چند روز بعد، دریافت که نمونه تصویری را بر روی صفحه عکاسی ایجاد کرده است. این نشان می داد که ماده مذکور شکلی از تشعشع را که بعدا ماری کوری آن را رادیواکتیویته نامید، از خود ساطع کرده است. 1922 میلادی نیلز بور نظریه طیف های ساختار اتمی را منتشر کرد و در 1927 میلادی اصل مکمل بودن را تنظیم می کند که رفتار پیچیده رادیواکتیویته را توصیف می کند.  ارنست رادرفورد فیزیکدان بریتانی نیوزلندی الاصل (1871-1937) بر روی رادیواکتیویته و ماهیت ذرات آلفا (دارای بار مثبت) تحقیق کرد و متوجه شد که بار مثبت اتم در مرکز آن و در هسته ای ریز و متراکم متمرکز است. در سال 1930 میلادی رادرفورد تشعشعات مواد رادیواکتیو را منتشر کرد.
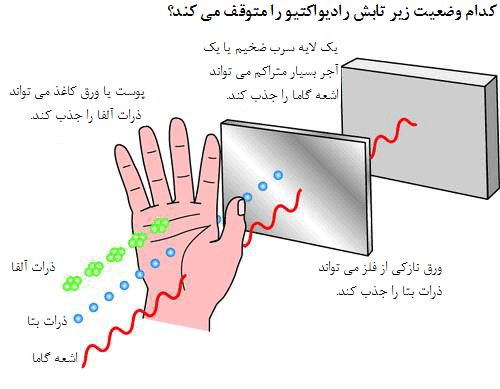
تابش های رادیواکتیو: چنان که گفته شد سه نوع تابش رادیواکتیو وجود دارد که ذرات آلفا از چهار ذره اتمی، یعنی دو پروتون و دو نوترون تشکیل می شوند. این ذرات ضعیف ترین نوع تابش رادیواکتیو هستند، بار الکتریکی مثبت دارند و مسیر آن ها را می توان با صفحه کاغذ مسدود کرد.
ذرات بتا قدرتمندتر از ذرات آلفا هستند و از ذرات اتمی که الکترون نامیده می شوند و بار منفی دارند، تشکیل می شوند. این ذرات از کاغذ عبور می کنند ولی ورقی از آلومینیوم می تواند مسیر آن ها را مسدود کند. پرتوهای گاما از همه قدرتمند ترند. آن ها امواج الکترومغناطیسی اند و فاقد بارالکتریکی اند. این ذرات به قدری پر قدرت اند که فقط لایه ضخیمی از سرب آن ها را متوقف می کند.
  منبع خوب ذرات آلفا، واپاشی آلفا اتم های سنگین (اتم هایی با وزن اتمی بیش تر از 106u) است. وقتی اتمی در واپاشی آلفا ذرات آلفا از خود تابش می کند، عدد جرمی اتم به علت 4 هسته در ذرات آلفا 4 تا کاهش پیدا می کند.
عدد اتمی این اتم در این واپاشی به علت از دست دادن دو پروتون، دو تا کاهش می یابد. بنابراین در این واپاشی یک عنصر جدید به دست می آید. برای مثال در یک تبدیل هسته ای، هنگامی که اورانیوم به توریوم یا رادیوم به رادون تبدیل می شود، واپاشی آلفا رخ می دهد.
 ذرات بتا الکترون ها یا پوزیترون های پر انرژی و پر سرعتی اند که از هسته های رادیواکتیو خاصی مانند پتاسیم - 40 نشر می شوند. دو نوع واپاشی بتا وجود دارد: β− و β+ . در واپاشی β− الکترون نشر می شود و در واپاشی β+ پوزیترون آزاد می شود:   اشعه گاما مانند نور مرئی، اشعه ایکس و یا امواج رادیویی، جزو امواج الکترومغناطیسی است با این تفاوت که پر انرژی تر از این امواج است.
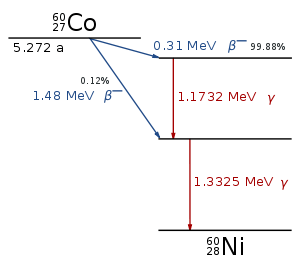
 یک مثال برای واپاشی گاما:
 موضوع مطلب : چهارشنبه 92 مرداد 16 :: 7:0 عصر :: نویسنده : نابغه

کشسان بودن، خاصیتی یک جسم یا ماده است که باعث برگشتن جسم به حالت عادی (قبل از اختلال و اعوجاج) آن می شود. اگر جسم یا ماده به صورت دقیق تری به وضعیت اولیه و اصلی اش باز گردد، کشسان تر خواهد بود.
 یک نوار رزینی (کائوچویی یا پلاستیکی) به راحتی کش می آید و هنگام رها شدن، به حالت اولیه اش برمی گردد؛ اما این نوار به اندازه ی تکه ای از سیم پیانو خاصیت کشسان ندارد.
با این که سیم پیانو به سختی کشیده می شود اما به دلیل بازگشت بهتر به طول عادی اش بعد از کشش، کشسانی تر است. یک رشته پیانوی واقعی می تواند صدها بار بدون کشیده شدن نواخته شود و بعد به مقدار قابل توجه و محسوسی از کوک خارج شود.
 فنر، نمادی از یک جسم کشسان است و هنگام کشیده شدن، یک نیروی بازگرداننده از سوی فنر به نیروی در حال کشش فنر اعمال می شود که تمایل فنر به بازگشت به طول اولیه اش را دارد. این نیروی بازگرداننده معمولا با مقدار کشش متناسب است و با قانون هوک بیان می شود.

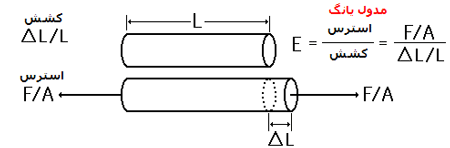
برای سیم ها خاصیت کشسانی معمولا بر اساس مقدار تغییر شکل (کشش) ناشی از استرس یا ضربه توصیف می شود(مدول یانگ).
مدول یانگ: برای توصیف خواص الاستیکی اجسام خطی مانند سیم ها، طناب ها یا ستون ها که هم فشرده و هم متراکم می شوند، یک پارامتر رایج که نسبت استرس(ضربه) به کشش (تغییر طول) است؛ این پارامتر را مدول یانگ می نامند:
خواص کشسانی حالت حجمی (حالت سه بعدی یا بالکی) مواد، عکس العمل مواد به تغییرات ایجاد شده تحت فشار را بیان می کند.
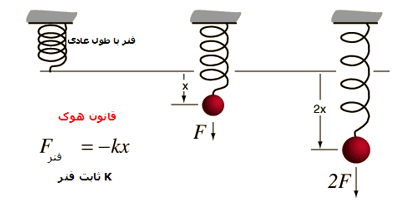
قانون هوک: 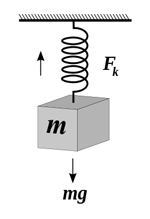
یکی از خاصیت های کشسانی آن است که اگر نیروی کششی وارد بر فنری، دو برابر شود، دو برابر باز می شود. این وابستگی خطی جابه جایی به نیروی کششی، قانون هوک نامیده می شود. علامت منفی در این رابطه به دلیل مخالفت فنر با کشش وارد شده بر آن است.
موضوع مطلب : چهارشنبه 92 مرداد 16 :: 6:59 عصر :: نویسنده : نابغه
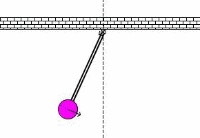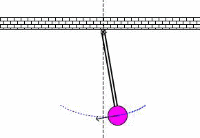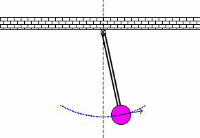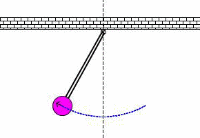
در کاربردهای صوتی، فرکانس تشدیدی، فرکانس معمولی ارتعاشی است که از پارامترهای فیزیکی جسم ارتعاشی تعیین می شود. این نظریه های اساسی فیزیکی که از فرکانس های معمولی تعیین می شوند، در کل محدوده فیزیک مانند مکانیک، الکتریسیته و مغناطیس و حتی در حوزه فیزیک جدید به کار می رود.
 برخی از مفاهیم فرکانس های تشدیدی عبارتند از:
1) بارها اتفاق افتاده است که ببینید، به ارتعاش درآوردن جسمی در فرکانس های تشدیدی اش راحت است اما در فرکانس های دیگر، کار چندان راحتی نیست.
 2) جسم در حال ارتعاش، فرکانس های تشدیدی خود را از یک تحریک پیچیده انتخاب می کند و در آن فرکانس ها به ارتعاش در می آید و به طور کلی، دیگر فرکانس های موجود در تحریک شدن خود را حذف می کند.
3) بیش تر اجسام در حال ارتعاش، چندین فرکانس تشدیدی دارند.
حال به توضیح موارد 1 تا 3 می پردازیم:
سادگی تحریک کردن و ارتعاش جسم به حالت تشدید:
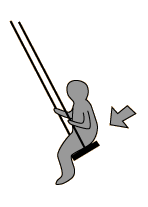
به حرکت تاب در پارک توجه کنید. این حرکت و نوسان مثالی از یک پاندول است؛ یعنی یک سیستم تشدیدی که تنها یک فرکانس تشدیدی دارد. یک هل کوچک به تاب، باعث می شود که هر بار تاب به سمت شما برگردد؛ شما می توانید به این کار ادامه دهید تا دامنه تاب را بالا ببرید.
 اگر سعی کنید که دوبرابر قبل در این فرکانس، به تاب نیرو وارد کنید، خواهید دید که این کار خیلی سخت است و حتی ممکن است دندان هایتان را هم از دست دهید!!!
انتخاب فرکانس های تشدیدی توسط جسم مرتعش: در بالا اشاره شد که جسم مرتعش با فیلتر کردن فرکانس های دیگر در حالت تحریک شده خود، فرکانس های تشدیدی را انتخاب می کند. 
اگر به جسمی که به فنر متصل شده است، به یک تکه چوب ضربه بزنید، حرکت اولیه آن ممکن است پیچیده باشد؛ اما تشدید اصلی در فرکانس عادی و طبیعی خود در ضربه به سمت بالا یا پایین اتفاق می افتد. ضربه سبک با چوب یک تحریک پیچیده با مؤلفه های فرکانسی زیاد است اما همچنان فنر فرکانس طبیعی خود را انتخاب کرده و به آن پاسخ می دهد.
موضوع مطلب : چهارشنبه 92 مرداد 16 :: 6:56 عصر :: نویسنده : نابغه
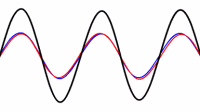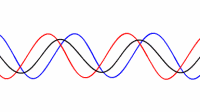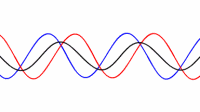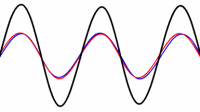
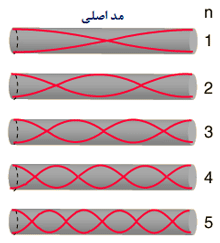
حالت اصلی ارتعاشی یک طناب کشیده شده طبق رابطه L=λ/2 به صورت دو برابر بودن طول موج نسبت به طول طناب تعریف می شود:
 با استفاده از روابط پایه ای در فیزیک می توان رابطه سرعت موج، طول موج و فرکانس را به دست آورد:
 رابطه x=vt را به خاطر آورید. اگر طول موج را هم به صورت یک حالت خاص فاصله در فضا در نظر بگیرید، خواهیم داشت:
λ = vT
که زمان لازم برای انجام کامل یک نوسان را با T نشان داده ایم. حال با استفاده از رابطه f=1/T رابطه استاندارد امواج را به دست می آوریم:
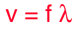 این یک رابطه ی عمومی در امواج است که برای امواج صوتی و نوری و سایر امواج الکترومغناطیسی و امواج واقع در محیط مکانیکی به کار می رود.
با استفاده از رابطه اخیر و L=λ/2 داریم: 
از آن جایی که سرعت موج با رابطه
 داده می شود، فرکانس موج خواهد بود:
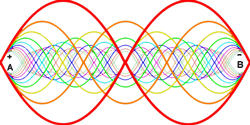
 طناب در تمام هارمونیک های اصلی ارتعاش خواهد داشت. هر کدام از این هارمونیک ها یک موج ایستاده روی طناب تشکیل خواهند داد:
 این تصویر یک موج ایستاده تشدیدی روی طناب را نشان می دهد. توسط یک ارتعاش کننده در 120 هرتز می توان این موج را تولید کرد.
هارمونیک ها:در بالا اشاره شد که یک طناب ایده آل مرتعش با فرمانس اصلی و تمام هارمونیک های آن فرکانس ارتعاش خواهد کرد. مکان گره ها و شکم ها دقیقا مخالف حالت ستون هوا خواهد بود:
و هارمونیک ها مضرب های صحیحی هستند. موضوع مطلب : چهارشنبه 92 مرداد 16 :: 6:53 عصر :: نویسنده : نابغه
 در مقاله ذرات بنیادی ریز 1 و 2 به انواع مختلف ذرات بنیادی مانند کوارک ها، لپتون ها و ... اشاره شد. هم چنین گفتیم که پروتون ها و نوترون ها جزو باریون ها به حساب می آیند. در این مقاله مختصری راجع به این نوکلئون ها و اتم ها توضیح خواهیم داد. 
|
 حرکت پروتون |
جرم هر پروتون، 938/3 میلیون الکترون ولت (انرژی معادل جرم، فرمول انیشتین را به یاد بیاورید!) و سرعت حرکت آن، 15 کیلومتر در ثانیه است.
تعداد پروتون ها در طبیعت، 5 برابر تعداد نوترون هاست؛ زیرا فراوان ترین اتم موجود در عالم، هیدروژن است که هسته آن نوترون ندارد.
برخی از دانشمندان، پروتون ها را ذرات پایداری می دانند. در حالی که عده ای دیگر حدس می زنند که این ذرات بعد از 1031 سال به انرژی خالص تبدیل می شوند.
 نوترون ها:
نوترون ها:
 نوترون ها:
نوترون ها:نوترون ها همان گونه که از نامشان پیداست، دارای بار صفر (خنثی) هستند و برای همین نیز ردیابی آن ها مشکل است. نوترون ها ساختار پایداری دارند. جرم یک نوترون، 939/6 میلیون الکترون ولت است؛ یعنی به جرم یک پروتون، بسیار نزدیک است.
|
نوترون ها، باعث نگه داشتن پروتون ها در کنار همدیگر می شوند و هسته را پایدار نگه می دارند.
|
نوترون به همراه پروتون، هسته اتم را می سازد؛ اما در خارج اتم، هر نوترون بلافاصله به یک پروتون، یک الکترون و یک پاد نوترینو تبدیل می شود. بنابراین هر نوترون می تواند سازنده یک ذره هیدروژن باشد.
 ذره های بنیادی در شرایط مکانی و زمانی گوناگون، اشکال مختلفی پیدا می کنند؛ گاه به یکدیگر تبدیل می شوند و گاه ماده به انرژی و انرژی به ماده تبدیل می شود.
ذره های بنیادی در شرایط مکانی و زمانی گوناگون، اشکال مختلفی پیدا می کنند؛ گاه به یکدیگر تبدیل می شوند و گاه ماده به انرژی و انرژی به ماده تبدیل می شود.
تمام اتم ها به جز اتم هیدروژن برای پایدار ماندن، به تعدادی نوترون در هسته خود نیاز دارند که معمولا با تعداد پروتون هایشان برابر است. البته هیدروژنی که در هسته خود، نوترون داشته باشد، هیدروژن سنگین نامیده شده و آب سنگین را تشکیل می دهد.
نوترون در سال 1932 توسط جیمز چادویک، فیزیک دان انگلیسی کشف شد. وی آزمایشی ترتیب داد که در آن، ذرات آلفا به اتم های بریلیوم اصابت می کردند و هدف، تولید تابش هایی با تراز انرژی بالا بود. این تابش بسیار قوی می توانست پروتون ها را به بیرون هسته اتم های مختلف براند. این پس زنی پروتونی با عقاید علمی قبلی در تضاد بود. چادویک نمی خواست قبول کند که قوانین فیزیک اشتباه اند؛ به همین دلیل به تحقیق در مورد این تابش پرداخت.
او کشف کرد که "تابش" در واقع اصلا تابش نبوده است! مجموعه ای از ذراتی بود که جرمی مساوی با پروتون داشتند اما هیچ باری نداشتند. به همین دلیل وی آن ها را نوترون نامید.
به دلیل این کشف، وی جایزه نوبل فیزیک را در سال 1935 دریافت کرد.
برگرفته از کتاب "دهر" نوشته دکتر حسین سالاری
موضوع مطلب :

هواشناسی علم مطالعه ی جو است. جو لایه ای است حاوی گازهای اطراف زمین که کنش و بر هم کنش هایی با مقیاس های زمانی و مکانی متفاوت در آن صورت می گیرد. حاصل این کنش و بر هم کنش ها هوایی است که توسط ما در سطح زمین مشاهده می شود.
اقلیم شناسی، بررسی عمومی تر در حیطه ی علم هواشناسی است که به تجربه و تحلیل اتفاقات در مدت یک روز، یک سال و یا بیش تر در نقطه ی معینی می پردازد.
جو را متشکل از یک سری لایه های جداگانه می توان در نظر گرفت که با چگونگی تغییرات دمای هوا در ارتفاعات مختلف از یکدیگر جدا می شوند. برای یک جو استاندارد، این لایه ها تقریبا به ترتیب زیر از یکدیگر تفکیک می شوند.
وردسپهر:
لایه ایست بسیار متغیر که به طور متوسط ارتفاع آن از حدود 8 کیلومتر در قطب تا 16 کیلومتر در استوا تغییر می کند. این تغییرات تابعی از زمان و مکان می باشد.
وردایست:
مرز بین وردسپهر و پوش سپهر است که شیب تغییرات دما در آن تغییر جهت می دهد.
پوش سپهر:
از مرز وردایست تا ارتفاع 47 کیلومتر پوش سپهر است.
پوش ایست:
از انتهای پوش سپهر تا ارتفاع 52 کیلومتر پوش ایست است.
میان سپهر:
از 52 کیلومتر تا 83 کیلومتر میان سپهر است.
میان ایست:
تا ارتفاع 93 کیلومتری از سطح زمین میان ایست است.
گرم سپهر:
از ارتفاع 93 کیلومتری به بالا گرم سپهر است.
لازم به توضیح است که لایه های فوق از نظر ضخامت و تغییرات دما تا حدودی به عرض جغرافیایی محل بستگی دارد و شکل به طور تقریبی ترسیم شده است.
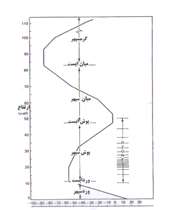
لایه دیگری که در تعریف های فوق بیان نشده و از نظر مخابرات دارای اهمیت است لایه یون سپهر نام داشته و در ارتفاع بین 80 تا 400 کیلومتری قرار می گیرد. در این لایه اتم های نیتروژن و اکسیژن با جذب طول موج های کوتاه اشعه ی خورشیدی یونیزه می شوند، در نتیجه ضخامت این لایه در طول روز بیش تر از ضخامت آن در طول تاریکی است.

از نظر الکتریکی یون سپهر اثر چندانی در تغییرات هوا ندارد و تنها تاثیری که ممکن است در زندگی روزمره ی ما داشته باشد اثر آن روی دریافت امواج رادیویی می باشد. برای توضیح بیش تر این موضع استفاده از رادیو را در روز و شب مثال می زنیم: بدین ترتیب که ایستگاهی را که در شب به راحتی و وضوح دریافت می کنید در طول روز قادر به دریافت علایم آن ایستگاه نخواهید بود.
علت این امر در لایه ی F یون سپهر می باشد، بدین ترتیب که این لایه که در طول شب و روز وجود دارد مسئول بازتاب امواج AM رادیو می باشد. از طرف دیگر این امواج توسط لایه ی D که فقط در طول روز وجود دارد جذب می شوند؛ در نتیجه این امواج تنها در طول شب قادر به رسیدن به لایه ی F و بازتاب روی آن هستند.
قسمت اعظم ضخامت جو در اطراف زمین از مخلوط گازهای دائمی تشکیل شده است که هوای خشک نامیده می شوند. مواد دیگری نیز در جو وجود دارند که مقدار آن ها متغیر است.
این مواد شامل بخار آب، مواد آلی و معدنی از قبیل گرد و غبار، دود و سایر آلوده کننده هایند. هوای خشک خالص که کاملا شفاف و بدون بو است از 87 درصد نیتروژن، 21درصد اکسیژن، 1 درصد آرگون، 0/03 درصد دری اکسیدکربن و مقادیری از گازهای دیگری هم چون هیدروژن، ازن، نئون و غیره تشکیل شده است.
از این گازهای دائمی جو، دی اکسیدکربن به علت جذب برخی از تشعشعات ساطع شده از زمین و تابش مجدد آن ها به طرف زمین از اهمیت اقلیمی خاصی برخوردار است.
این گاز به طور پیوسته توسط سبزینه ها تنفس و توسط جانوران تولید می شود. با سوختن برخی از مواد فسیلی، فعالیت آتشفشان ها و استهلاک خاک نیز مقادیر زیادی از این گاز تولید می شود.

بخار آب نیز که شفاف و بی بو است حجم بسیار متغیری را در جو به خود اختصاص می دهد. این حجم در نواحی مرتفع تقریبا صفر و در سرد جو تا حدود 3 تا 4 درصد حجم کل هوا در نزدیک سطح و در نواحی گرم و مرطوب تغییر می کند.
از آن جا که بخار آب از طریق تبخیر آب در سطوح خشکی و دریا به آسمان می رود؛ به ناچار در نواحی کم ارتفاع سطح زمین تجمع می یابد.
اهمیت بخار آب بیشتر از آن چیزی است که درصد حضور آن نشان می دهد، زیرا نه تنها باعث ایجاد ابر و بارندگی می شود بلکه مقدار زیادی از اشعه ی خورشید و اشعه ی ساطع شده از سطح زمین را جذب و یا پراشیده می کند؛ علاوه بر این مقدار زیادی گرما که جهت تبخیر مورد استفاده قرار گرفته است، در زمان میعان دوباره در جو آزاد می شود. بنابراین می توان از بخار آب به عنوان عامل اصلی انتقال انرژی در جو نام برد.
جو از طریق برخی از خواص شیمیایی و فیزیکی گازهای تشکیل دهنده خود می تواند انرژی خورشیدی تابش شده به سمت زمین را نیز کنترل کند برای مثال گاز ازن که بیش ترین غلظت را در فاصله ی 20 تا 35 کیلومتری از سطح زمین دارد به عنوان یک سپر محافظ در مقابل اشعه ی کشنده فوق بنفش خورشید عمل می کند.
برخی از ناخالصی های موجود در جو نقش بسیار مهم در تشکیل ابر و ایجاد بارندگی ایفا می کنند. این ذرات ناخالصی در هوا باعث می شوند که ذرات آب در روی آن ها به مایع تبدیل شده و عاملی برای ایجاد این فرآیند باشند.
موضوع مطلب :

تشکیل ابر نتیجه صعود هوا و سرد شدن آن به صورت بی دررو است. وقتی بسته هوایی صعود می کند، فشار هوای اطراف آن کاهش می یافته و باعث انبساط این بسته هوا می شود.

از آن جا که انرژی موردنیاز برای انبساط از هوای داخل بسته تامین می شود، دمای هوای این ناحیه کاهش می یابد.
با توجه به این که هوا یک هادی بسیار ضعیف برای گرماست، فرض بر این است که هیچ گونه تبادل انرژی بین این بسته هوا و نواحی دیگر صورت نمی گیرد.
فرآیندی که در آن هیچ گونه گرمایی به سیستم داخل و یا از آن خارج نشود "بی دررو" می نامند.
پایداری جو:
ارزیابی پایداری جو مبتنی بر دانشی است که از محیط در اختیار داریم. آهنگ کاهش بی درروی هوای خشک (DALR) و آهنگ کاهش دمای بی درروی اشباع (SALR) ارزش زیادی در ایجاد توانایی پیش بینی چگونگی تشکیل ابرها و شرایط جویی مربوط دارند.
1. جو ناپایدار:
هرگاه یک بسته هوای اشباع و یا غیراشباع که به صورت بی دررو بالا رفته و سرد می شود، تمایل به صعود داشته باشد، جو را مطلقا ناپایدار می نامند. در شکل زیر یک بسته هوا که در سطح AA دمایی بیشتر از دمای محیط دارد دارای چگالی کمتری است و در نتیجه سبکتر بوده و بالا می رود. از طرف دیگر برای یک بسته هوایی که نزول می کند به صورت بی دررو گرم شده و دمای آن در هر سطحی کمتر از دمای هوای محیط بوده و در نتیجه به نزول خود ادامه می دهد. در یک جو مطلقا ناپایدارELR>DALR>SALR. (ELR: آهنگ دما به صورت بی دررو)
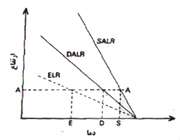

2. جو پایدار:
هرگاه یک بسته هوای اشباع که در حال صعود به صورت بی دررو است، سرد می شود و تمایل به بازگشت به سطح اولیه خود را داشته باشد جو را پایدار می نامند. در شکل 5-14 یک بسته هوا در سطح BB دمایی کمتر از دمای محیط دارد ولی چون دارای چگالی بیشتری است سنگنتر از هوای اطراف خود بوده، تمایل به بازگشت به سطح اولیه خود را دارد. از طرف دیگر برای یک بسته هوایی که در حال نزول است و به صورت بی دررو گرم می شود، چون گرم تر از هوای اطراف است تمایل به بازگشت به سطح اولیه خود را خواهد داشت. بنابراین در جو مطلقا پایدار باید نامساوی زیر برقرار باشد: DALR>SALR>ELR.
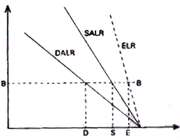
3. ناپایداری مشروط:
هرگاه یک بسته هوای غیر اشباع که در حال صعود بوده و به صورت بی دررو سرد شود، در سطحی که دمای آن پایین تر از دمای محیط است قرار بگیرد، جو را به صورت مشروط ناپایدار می نامند. در شکل 5- 15 این شرایط در سطح CC برقرار است و از آنجا که بسته هوا چگالی تر از هوای اطراف آن است، تمایل به بازگشت به سطح اولیه خود را دارد و در هر حال یک بسته هوای اشباع در این سطح که در حال صعود به صورت بی دررو سرد شده است، دمایی بیشتر از دمای هوای اطراف را داشته و به صعود خود ادامه خواهد داد. در یک جو مشروط ناپایدا ر باید نامساوی زیر برقرار باشد: DALR>ELR>SALR.

4. پایداری خنثی:
هرگاه ELR با DALR و یا ELR با SALR مساوی باشد، جو در حالت خنثی قرار دارد. در این حالت بسته هوا که صعود (نزول) نموده و به صورت بی دررو سرد (گرم) شده، تمایل به باقی ماندن در وضعیت جدید خود را دارد. از آنجا که DALR ثابت است، اگر برای SALR نیز مقداری معین در نظر بگیریم، آن گاه نقش ELR در تعیین وضعیت پایداری جو در یک زمان مورد نظر اساسی خواهد بود. با ثبت دمای هوا در طی یک صعود کاوشگر ممکن است قادر به تعیین ELR در لایه های مختلف وردسپهر بوده، بنابراین بتوانیم پایداری در این لایه ها را ارزیابی کنیم.
موضوع مطلب :

همان گونه که مستحضرید اهمیت علم روان شناسی درکشورمان به صورت مدرن آن در چند دهه ی اخیر، بیش از پیش آشکار شده است.
به عبارت دیگر می توان گفت برای حل قسمت عمده ای از مسائلی که بشر امروز با آن روبه رو است باید از علم روانشناسی کمک گرفت.
در همین راستا کتاب روان شناسی سال سوم رشته ادبیات و علوم انسانی بیش از یک دهه است که در چرخه ی آموزش کشور قرار دارد. مرکز یادگیری تبیان نیز به منظور یاری رساندن به شما دانش آموزان و دانشجویان عزیز، سلسله مقالاتی را در این ارتباط در نظر گرفته، که امید است مورد بهره مندیتان قرار گیرد.
رفتار گرایی مکتبی است که به وسیله ی جان واتسون امریکایی پایه ریزی شده و هدفش مطالعه ی رفتار قابل مطالعه و اندازه گیری است.

واتسون در مزرعه ای در کارونیای جنوبی متولد شد. و طبق اظهار خودش، وی در ابتدا محقق نبود. واتسون در آغاز بیش تر به فلسفه پرداخته بود تا روان شناسی.
او رساله ی دکترایش با عنوان آموزش حیوانی: رشد روانی موش سفید را در سال 1903 به پایان رسانید.
واتسون در سال 1913 مقاله ای با عنوان روان شناسی به گونه ای که رفتار گرا آن را می بیند به چاپ رسانید.
این مقاله که بعد ها به بیانیه ی رفتار گرا مشهور شد به صورت زیر شروع می شد: روان شناسی به گونه ای که رفتار گرا آن را می بیند شاخه ای کاملا عینی و آزمایشی از علوم طبیعی است. هدف آن، پیش بینی و کنترل رفتار است.
رفتار گرا در تلاش خود برای به دست آوردن یک الگوی واحد از پاسخ حیوان، هیچ مرزی بین انسان و حیوان نمی شناسد.
رفتار انسان با تمام ظرافت و پیچیدگی آن، تنها بخشی از طرح کلی تحقیقی رفتار گرایی را تشکیل می دهد. واتسون معتقد بود که روان شناسی حیوانی باید یک رشته ی تخصصی مهم در حوزه ی روان شناسی باشد و تصور می کرد به کار گیری حیوانات به عنوان آزمایش شونده، کنترل کامل تر شرایط آزمایشی را ممکن می سازد. چون روان شناسی علمی عینی است. پس باید روش های تجربی را به کار برد.
واتسون اصولا چهار روش را مجاز می دانست:
برای واتسونی که شدیدا با درون نگری مخالف بود، واکنش های گفتاری، پدیده های قابل مشاهده به حساب می آمدند.احساس ها و عواطف به مفهوم واقعی کلمه باید رو می شدند زیرا راهی برای مشاهده ی مستقیم آن ها وجود نداشت!
از طرف دیگر هر شخصی می توانست احساس گرما یا سرما داشته باشد، آبی یا زرد ببیند. به هر حال برای واتسون، روان شناسی مطالعه ی رفتار معنی داشت نه تجربه
هم چنین انکار هشیاری و ذهن شاخصه رفتار گرایی بود. واتسون و رفتار گرایان به یک بدن بدون ذهن معتقد بودند.
از این ها گذشته، وی با فرآیند های مغزی رابط، کاری نداشت. مغز را جعبه ای اسرار آمیز می دانست و مطالعه ی واقعی روان شناسی را مطالعه ی پاسخ های عضله ها و غدد به محرک ها.
آن چه در موضع واتسون و مواضع رفتار گرایان بعدی بسیار اهمیت داشت، تأکید زیاد بر یادگیری بود. آنان معتقد بودند که عادت ها حاصل یادگیری اند و به وسیله ی دو قانون بنیادی شکل می گیرند: تأخر و فراوانی(تکرار)
او حافظه را یک فرآیند سه گانه می دانست:
اول از همه، باید یادگیری مهارت ها و یا عادت های کلامی وجود داشته باشد.
بعد به خاطر عدم استفاده، عملکرد آسیب می بیند و
بالاخره باید نوعی باز آموزی وجود داشته باشد که شامل تلاش و مقدار زمان لازم برای باز یافتن عملکرد یا همان تکلیف است.
این فرآیند هم در مورد حافظه ی حرکتی و هم کلامی صدق می کند.
اغلب اوقات این فروپاشی دستگاه های عضلانی، یک موهبت الهی است، زیرا ما را از اداره کردن تعداد زیادی سازماندهی های کلامی و حرکتی بیهوده، نجات می دهد. مانند فراموشی غم از دست دادن عزیزان که منجر به رفتار گوناگون می شود
هیجان نیز در دیدگاه واتسون مانند انواع دیگر رفتار ها، مستلزم واکنش های بدنی مشخص هستند.
انواع مختلف محرک ها می توانند هیجان های مختلف را فراخوانی کنند. مقدار زیادی از فعالیت های هیجانی نا آشکار بوده و فعالیت عضلات غیر ارادی درونی و غدد در آن ها دخالت دارند و بخش هم آشکار است و از طریق جلوه های صورت و حرکات بدن قابل مشاهده اند.
موضوع مطلب :
- آیا داروها زنانه و مردانه دارند؟
- حقایقی مهم در مورد قند میوه ها ( فروکتوز )
- دستهایتان چه شکلی هستند؟ + روان شناسی دستها
- رژیم غذایی دوپامین چیست و چگونه کار می کند
- کم خوابی می تواند این عوارض مرگبار را داشته باشد
- شخصیت شناسی از روی رنگ چشم ها
- این اشتباهات را در مورد زیبایی پوست, مو و دندان تان انجام می دهی
- هشدار های زبان شما در باره سلامتی شما
- با خلق و خوی آقایان در ساعات مختلف روز آشنا شوید
- تشخیص ابتلا به بیماری قلبی با توجه به سرعت راه رفتن شما!
- لیست آخرین مطالب