|
آرشیو وبلاگ پیوندهای روزانه لوگو آمار وبلاگ
نابغه کوچولو پنج شنبه 92 مرداد 17 :: 1:47 عصر :: نویسنده : نابغه
جفت مزدوج به اسیدها و بازهایی با ویژگی های مشترک گفته می شود. این ویژگی هایی مشترک، گرفتن/ از دست دادن پروتون بین دو جفت مزدوج است.
در واکنش اسید و باز، یک اسید به یک باز اضافه می شود و واکنش آن ها یک باز مزدوج به اضافه ی یک اسید مزدوج تولید می کند.
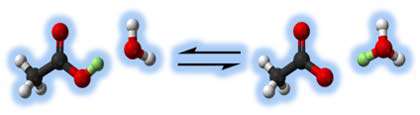
مثال: وقتی کلرید هیدروژن در آب حل می شود، تقریباً 100% آن با آب واکنش نشان می دهد تا یون های هیدرونیوم و کلرید تولید کند. کلرید هیدروژن یک اسید قوی است و ما در این جا می خواهیم این واکنش را به صورت یک طرفه بنویسیم: 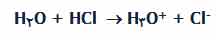
در واقع واکنش بین HCl و آب برگشت پذیر است اما تنها به مقدار بسیار کم! برای فهم بیشتر، تصور کنید اسید HA واکنش برگشت پذیری در آب دارد: 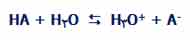 در واکنش رفت:
در واکنش برگشت
واکنش برگشت پذیر شامل دو اسید و دو باز است؛ ما به این جفت ها، جفت های مزدوج می گوییم:
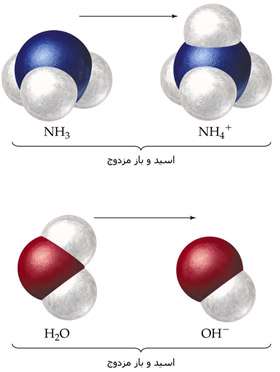
زمانی که اسید HA پروتون از دست می دهد، باز -A تشکیل می دهد و زمانی که باز -A دوباره پروتون می پذیرد، به طور قطعی اسید HA را دوباره تشکیل می دهد. این دو اسید و باز، یک جفت مزدوج هستند. اعضای یک جفت مزدوج از طریق حضور یا عدم حضور یون هیدروژن قابل انتقال با همدیگر فرق دارند. اگر در مورد اسید HA صحبت می کنید، -A باز مزدوج آن است و بالعکس. آب و یون هیدرونیوم نیز یک جفت مزدوج هستند. زمانی که آب به عنوان باز عمل می کند، یون هیدرونیوم اسید مزدوج آن است؛ زیرا یک یون هیدروژن اضافی دارد که می تواند دوباره آن را از دست بدهد.
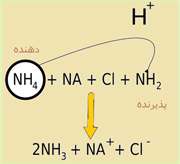
مثالی دیگر از جفت های مزدوج: واکنش بین آمونیاک و آب را در نظر بگیرید:
در واکنش رفت، آمونیاک باز است زیرا در حال گرفتن یون هیدروژن از آب است. یون آمونیوم نیز اسید مزدوج آن است چون می تواند یون هیدروژن را دوباره آزاد کند و آمونیاک تشکیل دهد. آب به عنوان اسید عمل می کند و یون هیدروکسید، باز مزدوج آن است. یون هیدروکسید می تواند یک یون هیدروژن بگیرد تا آب را دوباره تشکیل دهد. توجه: اسید یا باز قوی تر، مزدوج ضعیف تری دارد و اسید یا باز ضعیف تر، مزدوج قوی تری دارد. در نهایت این که:
یافتن مزدوج جفت های اسید باز: در هنگام یافتن اسید یا باز مزدوج به واکنش دهنده ها به دقت توجه کنید: واکنش دهنده ای مانند یک اسید، متناظر با باز مزدوجی در سمت دیگر واکنش است. برای شناسایی اسید مزدوج، به دنبال ترکیباتی که مرتبط با آن هستند، باشید. قبل و بعد از واکنش دادن را در نظر بگیرید؛
اسید مزدوج در سمت محصولات، یک یون هیدروژن به دست می آورد؛ بنابراین در سمت واکنش دهنده ها ترکیبی که یک یون هیدروژن کمتر از اسید مزدوج دارد، یک باز است. باز مزدوجی که در سمت محصولات است، یک یون هیدروژن از دست داده و بنابراین در سمت واکنش دهنده های واکنش، ترکیبی که یک یون هیدروژن بیشتر از باز مزدوج سمت محصولات دارد، یک اسید است.
سؤال: با این سؤال اطلاعات خود را بسنجید. در واکنش (الف) HF اسید است زیرا یک پروتون به H2O می دهد. (ب) -F باز مزدوج است زیرا از آب یک پروتون گرفته است. (ج) -F باز مزدوج است زیرا با اسید HF در یک پروتون فرق دارد. (د) +H3O اسید مزدوج است زیرا با آب که باز است، در یک پروتون فرق دارند. موضوع مطلب : پنج شنبه 92 مرداد 17 :: 1:44 عصر :: نویسنده : نابغه
واکنش های برگشت پذیر و برگشت ناپذیر، واکنش های شیمیایی هستند که دسته ی زیادی از واکنش های پیرامون ما به آن ها مرتبط است. بسیاری از این واکنش ها مسئول حوادث روزمره ای مانند تجزیه ی آمونیاک هستند.
مقدمه: تا سال 1803 مردم تصور می کردند که تمامی واکنش ها برگشت ناپذیر و یک طرفه است تا این که شیمیدان فرانسوی، Berthollet مفهوم واکنش های برگشت پذیر را مطرح کرد. در ابتدا او می دانست که کربنات سدیم و کلرید کلسیم با هم واکنش می دهند تا کربنات کلسیم و کلرید سدیم حاصل کنند؛ اما بعد از این که مشاهده کرد کربنات سدیم در اطراف دیواره های دریاچه ی نمک تشکیل می شود، فهمید که مقدار زیادی نمک در آب در حال تبخیر با کربنات کلسیم واکنش نشان می دهد تا کربنات سدیم تشکیل دهد و این به معنای آن است که بازگشت در واکنش اتفاق افتاده است. واکنش های شیمیایی توسط معادلات شیمیایی نشان داده می شوند. این معادلات شیمیایی به طور نمونه با فلش یک طرفه ی (
دیگر واکنش های شیمیایی ممکن است دارای فلش دوسر (
واکنش های برگشت ناپذیر: ما از کودکی آموخته ایم که واکنش های شیمیایی زمانی اتفاق می افتند که واکنش دهنده ها با همدیگر واکنش می دهند تا محصولات را تولید کنند. این واکنش های یک طرفه را واکنش های برگشت ناپذیر می نامیم. به بیان دیگر، واکنش های برگشت ناپذیر، واکنش هایی هستند که در آن ها واکنش دهنده ها به محصولات تبدیل می شوند و محصولات نمی توانند به واکنش دهنده ها تبدیل شوند. این واکنش ها در اصل مانند فرایند پختن کیک هستند!
ترکیبات در نقش واکنش دهنده ها ظاهر شده و با هم مخلوط می شوند و پخته می شوند تا کیک تولید شود! و این کیک مانند محصول رفتار می کند. این کیک نمی تواند به واکنش دهنده های خود یعنی (تخم مرغ، آرد و ...) تبدیل شود. بنابراین تنها محصولات در واکنش برگشت ناپذیر به واکنش دهنده ها تبدیل نمی شوند. همان گونه که در بالا ذکر شد، یک کیک نمی تواند بدون پخته شدن به وجود آید و بنابراین واکنش آن برگشت پذیر نیست. یک مثال واقعی تر از واکنش برگشت ناپذیر، احتراق یا سوختن است. احتراق معمولاً شامل سوختن یک ترکیب آلی مانند هیدروکربن و اکسیژن است تا دی اکسید کربن و آب تولید کند. از آن جایی که آب در حالت چند اتمی خود پایدار است؛ همان گونه که در زیر می بینیم، با محصول دیگر (CO2) واکنش نخواهد داد تا واکنش دهنده ها را تشکیل دهد. احتراق می تواند به صورت زیر باشد:
واکنش های برگشت پذیر: در واکنش های برگشت پذیر، واکنش دهنده ها و محصولات هرگز تمام نمی شوند! در واقع هر دوی آن ها (واکنش دهنده ها و محصولات) بدون تغییر واکنش می دهند و تولید می شوند. یک واکنش برگشت پذیر می تواند به صورت زیر خلاصه شود:
واکنش برگشت پذیر می تواند به دو واکنش شکسته شود:
این دو واکنش به طور همزمان اتفاق می افتند که به معنای این است که واکنش دهنده ها واکنش می دهند تا محصولات را تولید کنند؛ به همین ترتیب، محصولات با هم واکنش می دهند تا واکنش دهنده ها را تولید کنند. برخوردهای مولکول های در حال واکنش، موجب واکنش های شیمیایی در یک سیستم بسته (محصور) می شود. بعد از این که محصولات تشکیل شدند، پیوندها بین این محصولات شکسته می شود زیرا مولکول ها با همدیگر واکنش می دهند و انرژی کافی و لازم برای شکستن پیوندهای مولکول های محصولات و واکنش دهنده ها فراهم می شود. در زیر، مثالی از شکل مختصر واکنش برگشت پذیر و تجزیه ی فرایند برگشت پذیر واکنش 1 و واکنش 2 در یک زمان اتفاق می افتند زیرا هر دو در یک سیستم بسته هستند.
آبی : نیتروژن قرمز: اکسیژن 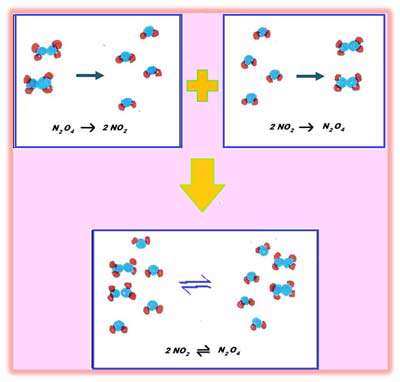 یک میز شامل 10 توپ قرمز و 10 توپ آبی را به عنوان واکنش دهنده های این واکنش در نظر بگیرید. هر توپ قرمز و آبی می توانند به هم برخورد کنند. تصور می کنیم برخورد هر توپ قرمز به آبی، باعث ایجاد گل شود. 5 جفت توپ قرمز و 5 جفت توپ آبی را در دو ردیف متفاوت بر روی میز به سمت همدیگر هل می دهیم. هر کدام از جفت های توپ های قرمز و آبی از هم جدا می شوند و به سمت ردیف مقابل می روند و دوباره واکنش دهنده ها را تشکیل می دهند. این فرایند بارها و بارها اتفاق می افتد؛ نه توپ ها تمام می شوند و نه واکنش دهنده ها. این حالتی از فرایند برگشت پذیر است.
برخلاف واکنش های برگشت ناپذیر، واکنش های برگشت پذیر منجر به تعادل می شوند؛ زیرا واکنش های برگشت پذیر، دارای جریان واکنشی در هر دو جهت هستند در حالی که واکنش های برگشت ناپذیر، فقط در یک جهت واکنش پیش می روند. برای فهم بیش تر این مطلب، مبحث مربوط به تعادل شیمیایی را ببینید. اگر محصولات در همان آهنگی تولید شده باشند که واکنش دهنده ها تولید شده اند، تعادل دینامیکی به وجود می آید. به عنوان مثال، اگر آهنگ پر شدن مخزن آب با آهنگ خالی شدن مخزن از آب برابر باشد( از یک سوراخ فرضی )، به نظر می رسد مقدار آب باقیمانده در مخزن، بدون تغییر باقی می ماند.
خود آزمایی کدام عبارت اشتباه است؟ (الف) احتراق یک تغییر شیمیایی است که مثالی از واکنش برگشت ناپذیر است زیرا که این فرایند نمی تواند ناتمام باقی بماند. (ب) واکنش (ج) دلیل این که واکنش برگشت ناپذیر نمی تواند به تعادل منجر شود، آن است که این واکنش ها تنها در یک جهت پیشرفت کرده و انجام می شوند؛ بنابراین واکنش هیچ وقت نمی تواند در تعادل باشد. (د) واکنش برگشت ناپذیر زمانی اتفاق می افتد که مولکول های واکنش دهنده در یک محیط بسته و محدود قرار می گیرند و به هم برخورد می کنند و انرژی تولید شده می تواند باعث تولید محصولات و همچنین تولید واکنش دهنده ها شود. موضوع مطلب : پنج شنبه 92 مرداد 17 :: 1:43 عصر :: نویسنده : نابغه
 گاهی یک جسم را در مکان واقعی آن مشاهده نمی کنید. اگر یک هواپیمای در ارتفاع کم از بالای سر شما عبور کند. هنگامی که شما با شنیدن صدای آن مکانش را در آسمان جستجو کنید، خواهید دید در یافتن محل واقعی آن اشتباه کرده اید.  علت این است که چند ثانیه طول می کشد تا صدا به گوش شما برسد. اگر سرعت هواپیما زیاد باشد، آن گاه هواپیما در آن چند ثانیه مسافت بیشتری طی می کند. شما برای تعیین موقعیت اجسام دو حس بینایی و شنوایی را با هم به کار می برید. اگر این دو حس اطلاعات متفاوتی را به شما بدهند شما به حس بینایی اعتماد می کنید.
سرعت نور چه قدر است؟ آیا شما هر رخدادی را در لحظه ی وقوع آن، می بینید، یا این که تا رسیدن نور به چشم شما، یک فاصله ی زمانی وجود دارد؟ اگر در مقابل یک دیوار با فاصله ای معین بایستید و خود را صدا بزنید، زمان کوتاهی می گذرد تا شما پژواک صدای خود را بشنوید. این مدت، زمانی است که طول می کشد تا صدا به دیوار رسیده و باز گردد. اگر آزمایش مشابهی با استفاده از پرتو چراغ قوه در مورد نور انجام دهید، هیچ فاصله ی زمانی مشاهده نمی کنید. علت این است که نور بسیار سریع تر از صدا حرکت می کند. نور در حدود یک میلیون بار سریع تر از صوت حرکت می کند. زمانی که طول می کشد تا نور به دیوار برخورد کند و بازگردد، کسر بسیار کوچکی از ثانیه است، این زمان، بسیار کوتاه تر از فاصله ی زمانی قابل تشخیص برای شما می باشد. صوت فاصله یک کیلومتر در هوا را به مدت تقریبی 3 ثانیه طی می کند ( سرعت صوت در هوا تقریباً 330 متر در ثانیه است . )از طرف دیگر نور همین مسافت را در زمان فوق العاده کوتاهی طی می کند ( نور در هر ثانیه مسافت 000/300 کیلومتر را طی می کند ) . رعد و برق همزمان اتفاق می افتند ، اما با سرعت های مختلفی به سوی ما حرکت می کنند و به همین دلیل در زمان های متفاوتی به ما می رسند .
فاصله ی ما تا کره ی ماه چقدر است؟  فاصله ی کره ی ماه تا کره ی زمین حدود 360000 کیلومتر است. آیا می دانید چگونه توانستند این فاصله را اندازه بگیرند؟ چند روش وجود دارد. اما در دقیق ترین اندازه گیری، یک آینه به کار می رود. یک پرتو نور لیزری به آینه ای روی کره ی ماه، هدف گیری می شود.
با آن که نور بسیار سریع حرکت می کند، حدود 3 ثانیه طول می کشد تا نور به ماه برسد و برگردد. این نشان می دهد که نور نیز سرعت معینی دارد. بنابراین فوری به چشم نمی رسد. با دانستن سرعت نور، فاصله ی زمین تا کره ی ماه را می توان محاسبه کرد. موضوع مطلب : پنج شنبه 92 مرداد 17 :: 1:42 عصر :: نویسنده : نابغه
 در این مطلب می خواهیم بدانیم به طور کلی، قدرت اسیدها و بازها چگونه تعیین می شود و این موضوع چه تأثثیری در انجام واکنش ها و نتایج آن ها دارد. خواص عمومی اسیدها:
- با فلزات واکنش می دهند. - دارای pH پایینی هستند. - زمانی که فنل فتالئین ( یک شاخص برای تعیین اسید و باز ) در حین تیتراسیون به محلول اسیدی اضافه می شود، محلول شفاف باقی می ماند. *** تیتراسیون، فرایندی شیمیایی است که مقدار مشخصی از ماده ی اصلی نمونه ی حل شده با افزودن مقدار دقیق و مشخص از یک ماده ی حل شده ی دیگری معین می شود. محلول با غلظت معلوم به تدریج به محلولی که ناشناخته است، اضافه می شود( این کار با استفاده از یک بورت انجام می گیرد که یک لوله آزمایش دراز با دریچه ای در انتهای خود است ). این کار تا زمانی انجام می گیرد که به نقطه ی هم ارزی (نقطه ی پایان) برسد. مقدار ماده ی ناشناخته در این حالت می تواند محاسبه شود. نقطه ی هم ارزی با تغییر خاصی معین می شود. به عنوان مثال، از رنگ ماده ی شاخص مانند لیتموس یا خاصیت الکتریکی.
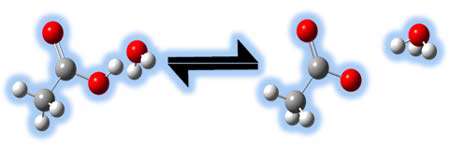
چه عاملی باعث ضعف یا قدرت اسیدها می شود؟ اسید قوی، اسیدی است که به آسانی تجزیه شود تا یون های هیدروژن تشکیل دهد. اسید ضعیف به راحتی نمی تواند تجزیه شود؛ بنابراین نمی تواند یون های هیدروژن را به راحتی تشکیل دهد. پس عامل قدرت اسیدها تجزیه ی آسان و رها کردن یون هیدروژن است. اسیدهایی مانند اسید استیک (HC2H3O2)، اسید هیدروفلوئوریک (HF)، اسید نیتروس ( اسیدی ناپایدار که فقط در محلول و به شکل نمک های نیترات شناسایی می شود( HNO2 ) جزو اسیدهای ضعیف هستند. در شکل زیر تجزیه ی اسید استیک را مشاهده می کنید.
اسیدهایی مانند اسید هیدروکلریک (HCl)، اسید سولفوریک (H2SO4) و اسید نیتریک (HNO3) اسیدهایی قوی هستند.
خواص عمومی بازها:
- الکترولیت هستند. - سطح pH آن ها بالاست. - زمانی که فنل فتالئین در هنگام تیتراسیون به محلول بازی اضافه شود، رنگ محلول، صورتی خواهد شد.
چه عاملی باعث ضعف یا قدرت بازها می شود؟ همانند یک اسید قوی، باز قوی به راحتی تجزیه می شود و یون های هیدروکسید تشکیل می دهد نه هیدرونیوم. باز ضعیف نمی تواند یه راحتی تجزیه شود؛ بنابراین نمی تواند به آسانی یون های هیدروکسید تولید کند. پس عامل قدرت بازها تجزیه ی آسان و رها کردن یون هیدروکسید است. بازهایی مانند آمونیاک (NH3)، یون فسفات (-PO4) و آب (H2O) ضعیف هستند. بازهایی مانند هیدروکسید سدیم (NaOH)، هیدروکسید پتاسیم (KOH) و اکسید کلسیم (CaO) بازهایی قوی هستند. در شکل زیر مثالی از انتقال پروتون را می بینید:
استفاده از مفهوم جفت های مزدوج اسید و باز به ما اجازه می دهد تا نظر خود را راجع به قدرت نسبی اسیدها و بازها به راحتی بیان کنیم. در جدول زیر غلظت یون هیدروژن و سطح pH را برای برخی مواد می بینیم:
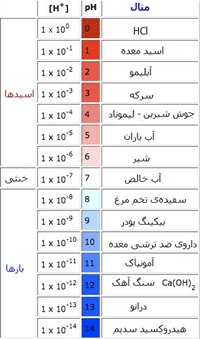
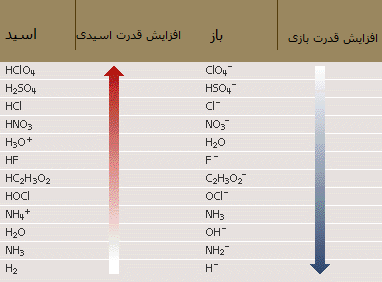
منظور از درانو (Drano) نوعی ماده است که برای تمیزی و باز کردن لوله ها و فاضلاب به کار می رود. در جدول زیر نیز افزایش قدرت برخی اسیدها و بازها را مشاهده می کنید: در ضمن، اسید و باز مزدوج هر کدام از مواد نیز در کنار آن نوشته شده است.
از طرف دیگر، واژه ی قوی یا ضعیف برای اسیدها و بازها به معنای توانایی آن ها برای هدایت جریان الکتریسیته است. اگر اسید یا باز قوی است، الکتریسیته را به طور قوی هدایت می کند و بالعکس.
اثبات تجربی رسانندگی اسید و باز: با استفاده از یک لامپ و یک مدار ساده می توان این مطلب را به خوبی درک کرد. این مدار با محلولی که شامل مقادیر زیادی یون است، کامل خواهد شد. اگر از اسیدی مانند HCl در محلول هدایت جریان الکتریسیته استفاده شود، لامپ بسیار پرنور روشن خواهد شد. اگر مدار با محلولی که شامل هیچ یونی نیست یا تعداد کمی یون دارد، کامل شود، محلول مورد نظر الکتریسیته را هدایت نخواهد کرد یا به طور ضعیف رسانای جریان الکتریسیته خواهد بود. به عنوان مثال، اسید استیک باعث این ضعف می شود. 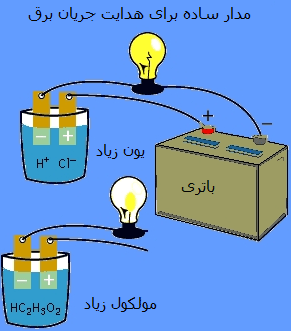 اصل رسانایی: اسید یا بازی که جریان الکتریسیته را به طور قوی هدایت می کند، شامل مقادیر زیادی یون است و اسید یا باز قوی نامیده می شود.
قدرت پیوندی: قدرت پیوندی اسیدها و بازها توسط مقادیر نسبی یون ها یا مولکول های آن ها در محلول معین می شود. پیوندها به صورت زیر نشان داده می شوند: باز اسید H-A M-OH که A یون منفی است و M یون مثبت است. اسیدهای قوی، یون های زیاد در محلول دارند؛ بنابراین پیوندهایی که H و A را متصل به هم نگه می دارند، باید ضعیف باشند. یعنی اسیدهای قوی به آسانی به یون های خود تجزیه می شوند. اسیدهای ضعیف، بیش تر در محلول مولکول رها می کنند و تعداد یون های آن ها در محلول کم تر است؛ بنابراین پیوندهای نگه دارنده ی H و A باید قوی باشند. اسیدهای ضعیف به راحتی نمی توانند به یون های خود تجزیه شوند اما مولکول های آن ها متصل به هم باقی می ماند. موضوع مطلب : پنج شنبه 92 مرداد 17 :: 1:40 عصر :: نویسنده : نابغه
برای فهم بهتر این مطلب، مطالعه ی مطالب اسید و باز توصیه می شود.
بازهای لوئیس: بهتر است این رابطه را با این نظر شروع کنیم که بازهای برونشتد- لوری زمانی که یون های هیدروژن می پذیرند، چه کاری انجام می دهند؟ در این جا سه باز برونستد - لوری آمونیاک، آب و یون هیدروکسید را بررسی کرده و وضعیت برای بقیه ی بازها نیز به همین ترتیب است.
نظریه ی اسید و باز برونشتد- لوری می گوید: این مواد (آمونیاک، آب و یون هیدروکسید) نقش بازی دارند زیرا با یون هیدروژن ترکیب می شوند. دلیل ترکیب آن ها با یون هیدروژن آن است که همگی جفت الکترون تنها دارند و این همان چیزی است که نظریه ی اسید و باز لوئیس نیز به آن اشاره کرده است. تا این قسمت، این دو نظریه کاملاً با هم سازگاری دارند.
در نگاه اول، چیزی به نظر نمی رسد و این دو نظریه فقط از دو زاویه ی متفاوت به مفاهیم اسید و باز پرداخته اند. اما در مورد دیگر واکنش های آب و آمونیاک نیز وضعیت به همین ترتیب است؟
در نظریه ی لوئیس، هر واکنشی که در آن آمونیاک یا آب، جفت الکترون های تنهای خود را برای تشکیل پیوند کوئوردینانسی استفاده کرده اند، آن ها را به عنوان باز معرفی خواهد نمود.  حال واکنشی را بررسی می کنیم . و بهتر است مطلب مربوط به پیوند کوئوردینانسی را نیز قبل از آن مطالعه کنید... آمونیاک با BF3 واکنش می دهد و از جفت الکترون تنهای خود استفاده می کند تا یک پیوند کوئوردینانسی با اوربیتال خالی بور (B) تشکیل دهد.
تا آن جا که آمونیاک درگیر واکنش است، دقیقاً همانند وقتی رفتار می کند که با یون هیدروژن واکنش می دهد (یعنی در این مورد هم با استفاده از جفت الکترون تنهای خود، پیوند کوئوردینانسی با یون هیدروژن تشکیل می دهد). بنابراین اگر قصد دارید آمونیاک را در این بحث به عنوان باز در نظر بگیرید، در موارد دیگر هم به عنوان باز خواهد بود.
اسیدهای لوئیس: اسید های لوئیس، پذیرنده های جفت الکترون هستند. در مثال قبل، BF3 با پذیرفتن جفت الکترونتنهای نیتروژن، نقش اسید لوئیس را دارد. در نظریه ی برونشتد- لوری، BF3 ابداً خاصیت اسیدی ندارد. سؤال:در مورد واکنش های اسید و باز دیگر (برای مثال، واکنش بین آمونیاک و گاز کلرید هیدروژن) وضعیت چگونه است؟ (NH3(g) + HCl (g) ........ NH4+(s) + Cl- (s چه چیزی دقیقاً جفت الکترونتنهای روی نیتروژن را می پذیرد؟ اغلب کتاب ها این مطلب را طوری می نویسند که گویی آمونیاک جفت الکترون تنهای خود را به یون هیدروژن می دهد (یک پروتون تنها بدون هیچ الکترونی در اطراف آن). این نظرات گمراه کننده اند معمولاً نمی توان یون هیدروژن آزادی در سیستم های شیمیایی به دست آورد.
این یون ها به قدری واکنش پذیرند که همیشه به ساختار دیگری متصل می شوند. اما . . . هیچ یون هیدروژن ترکیب نشده ای در HCl وجود ندارد.
از طرفی، در HCl اوربیتال خالی وجود ندارد که بتواند یک جفت الکترون بپذیرد. پس با این حساب آیا HCl یک اسید لوئیس است؟ کلر الکترونگاتیوتر از هیدروژن است و این به معنای آن است که کلرید هیدروژن یک مولکول قطبی خواهد بود. الکترون ها در پیوند کلر- هیدروژن به سمت کلر جذب خواهند شد و مختصری آن را منفی خواهند کرد و هیدروژن را با اندکی بار مثبت تنها خواهند گذاشت.  جفت الکترون تنها روی نیتروژن در مولکول آمونیاک به سمت اتم هیدروژن مولکول HCl با اندکی بار مثبت، جذب می شوند. هر چه این الکترون ها نزدیک می شوند، الکترون های پیوند کلر- هیدروژن باز هم به سمت کلر رانده می شوند. در نهایت، یک پیوند کوئوردینانسی بین نیتروژن و هیدروژن تشکیل می شود و کلر به صورت یون کلر جدا می شود. این مطلب با استفاده از " نمادگذاری خمیده" که معمولاً در مکانیسم های واکنشی آلی مورد استفاده قرار می گیرد، بهتر فهمیده می شود: 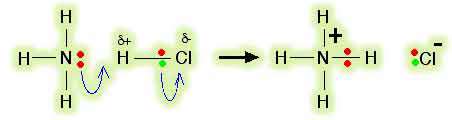 کل مولکول HCl نقش اسید لوئیس را دارد و یک جفت الکترون از آمونیاک می پذیرد و در حین واکنش، تفکیک می شود. اسیدهای لوئیس الزاماً مجبور نیستند اوربیتال خالی آماده داشته باشند.
موضوع مطلب : چهارشنبه 92 مرداد 16 :: 7:4 عصر :: نویسنده : نابغه
نظریه ی حالت گذار پیشنهاد می کند هنگامی که مولکول های واکنش دهنده به نزدیکی همدیگر می رسند، به طور آنی در حالتی با پایداری کم تر از پایداری حالت واکنش دهنده ها و محصولات خواهند بود.
در نظریه ی حالت گذار، مکانیسم اندرکنش واکنش دهنده ها مطرح نیست؛ معیار مهم آن است که مولکول های واکنش دهنده، انرژی کافی برای غلبه بر سد پتانسیل انرژی (انرژی فعال سازی) داشته باشند تا واکنش دهند.
در این حالت با پایداری کم تر، اتمها خود را از نو آرایش می دهند، پیوندهای اصلی ضعیف می شوند و پیوندهای جدید اندکی تشکیل می شوند.
انرژی پتانسیل سیستم در این نقطه افزایش می یابد؛ زیرا:
· مولکول های واکنش دهند هی در حال واکنش، باید به نیروهای دافعه ی متقابل بین الکترون های لایه ی بیرونی تر اتم های سازنده ی خود غلبه کنند. · اتم ها باید هنگام شکسته شدن پیوندهایشان از هم جدا شوند.
برای یک واکنش دو مولکولی، حالت گذار هنگامی تشکیل می شود که پیوندهای مولکول های قدیمی، ضعیف می شوند و پیوندهای جدید شروع به شکل گیری می کنند یا این که ابتدا پیوندهای قدیمی می شکنند تا حالت گذار را شکل دهند و بعد از آن پیوندهای تازه تشکیل می شوند.
در مثال زیر، حالت گذار اتفاق می افتد:
رسیدن به حالت گذار، انرژی زیادی لازم دارد؛ بنابراین این حالت، مادهای با انرژی زیاد به وجود میآید. این افزایش در انرژی پتانسیل با سد پتانسیلی متناظر است که اگر واکنش به پیش رود، مولکولهای واکنشدهنده باید از آن عبور کنند.
آرایش اتمها در بیشینهی این سد پتانسیل، کمپلکس فعال یا حالت گذار نامیده میشود و یک حالت واسطهی گذرا بین واکنشدهندهها و محصولات است. · حالت گذار یا کمپلکس فعال شده، یک حالت ترکیبی ناپایدار گذرای مولکولهای واکنشدهنده است که در یک بیشینهی انرژی پتانسیل اتفاق میافتد. این ترکیب هم می تواند در جهت تولید محصولات به پیش رود و هم به سمت واکنش دهندههای تغییر نیافته برگردد. · تفاوت انرژی بین واکنش دهنده ها و بیشینه ی انرژی پتانسیل به انرژی فعال سازی برمی گردد.
حرکت واکنش از روی بیشینهی انرژی پتانسیل اغلب با دیاگرام هماهنگ واکنش نشان داده می شود.
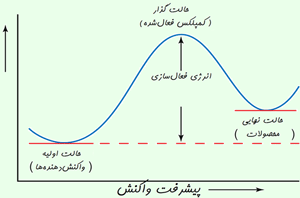
افزایش در انرژی پتانسیل با سد پتانسیلی متناظر است که اگر واکنش به پیش رود، مولکولهای واکنشدهنده باید از آن عبور کنند.

شکلهای زیر، نظریهی حالت گذار را با اشاره به واکنش بین هیدروژن و ید برای تولید یدید هیدروژن نشان میدهد:
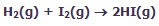 در این فرایند، مولکول های واکنشدهنده به همدیگر نزدیک میشوند و زمانی که آن ها در حین متعادلسازی واکنش برای حالت گذار یا کمپلکس فعالشده به پیش میروند:
 پیوندهای اصلی ضعیف میشوند.  پیوندهای جدید نسبتاً تشکیل میشوند.
در این شکل، واکنش در حهت تولید محصول پیشرفت میکند. این شکلها را به دقت نگاه کنید تا ضعیف شدن پیوندهای اصلی و تشکیل پیوندهای جدید را بعد از تولید محصولات ببینید:
همان طور که دما افزایش پیدا می کند، سهم اجزای واکنش دهندهای که می توانند به بیشینه ی انرژی پتانسیل برسند، افزایش پیدا می کند؛ افزایش تعداد مولکول ها ی محصول که در هر ثانیه تشکیل می شوند، آهنگ واکنش را افزایش می دهد.  نکات کلیدی:
 افزایش دمایی مانند 10 K آهنگ واکنش بسیاری از واکنش های شیمیایی را تقریباً دو برابر می کند. افزایش دمایی مانند 10 K آهنگ واکنش بسیاری از واکنش های شیمیایی را تقریباً دو برابر می کند. نظریه ی برخورد بر پایه ی انرژی جنبشی است و فرض میکند که ذرات باید دارای دو شرط جهت مناسب و انرژی جنبشی کافی باشند تا واکنش دهنده ها به محصول تبدیل شوند.
 کم ترین انرژی جنبشی لازم برای یک برخورد توسط مولکول های واکنش دهنده برای تشکیل محصولات، انرژی فعال سازی (Ea) نامیده میشود.  نسبت مولکول های واکنش دهنده ای که با انرژی جنبشی مساوی با انرژی فعال سازی واکنش می دهند، با افزایش دما زیاد می شود.
 نظریه ی حالت گذار پیشنهاد می کند که هنگام نزدیک شدن مولکول های واکنش دهنده، یک کمپلکس فعال شده ی گذرا (حالت گذار) در بیشینه ی انرژی پتانسیل تشکیل می شود.  در نظریه ی حالت گذار، انرژی فعال سازی، تفاوت انرژی بین واکنش دهنده ها و بیشینه ی انرژی پتانسیل است.
 در کمپلکس فعالشده، پیوندهای اصلی ضعیف شده و پیوندهای جدید نسبتاً تشکیل میشوند. کمپلکس فعالشده ممکن است در جهت تولید محصولات به پیش رود و یا به سمت واکنشدهندهها برگردد.  زمانی که دما افزایش پیدا می کند، نسبت بزرگ تری از مولکول های واکنش دهنده می تواند به بیشینه ی انرژی پتانسیل رسیده و کمپلکس فعال شده تشکیل دهند. بنابراین تعداد مولکول های محصول تشکیل شده در هر ثانیه افزایش پیدا می کند. موضوع مطلب : چهارشنبه 92 مرداد 16 :: 7:2 عصر :: نویسنده : نابغه

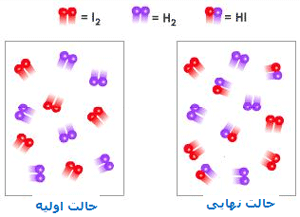
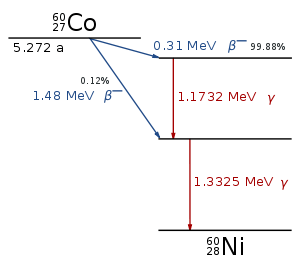
مواد رادیواکتیو از اتم های ناپایداری تشکیل شده اند که به طور متوالی تجزیه شده و انرژی سطح بالایی به نام تابش رادیواکتیو را آزاد می کنند. این اتم ها نهایتا عناصر جدیدی را تشکیل می دهند. طی این تجزیه و واپاشی، ذرات یا اشعه هایی از اتم ها ساتع می شود که سه نوع اند: ذرات آلفا ، ذرات بتا ، و پرتوهای گاما.
اطلاعات اولیه:
تاریخچه: حدود اواخر قرن نوزدهم اکثر دانشمندان بر این عقیده بودند که تمام مسائل عمده فیزیک به غیر از چند مورد جزئی که برای قطعیت دادن به برخی نظریه های ضروری بود، حل شده است. در سال 1895 ، رنتگن اشعه ایکس را کشف کرد. این اشعه نخست در معاینات پزشکی به کار رفت و بعدها برای بررسی ساختمان اساسی مواد مورد استفاده قرار گرفت. چند ماه بعد ماری کوری این پدیده جدید را رادیو اکتیو نامید. او و همسرش پیر کوری علاوه بر این ، پولونیم (po ، فلز ضعیف) و رادیم (Ra ، فلز قلیایی خاکی قوی) را کشف کردند. ماری کوری نخستین کسی بود که از اصطلاح «رادیواکتیو» برای موادی که فعالیت الکترومغناطیسی قابل توجه دارند، استفاده کرد. خاصیت رادیواکتیویته این دو عنصر جدید از اورانیم بیش تر بود.
سیر تحولی و رشد:  ماری کوری تحقیق خود را با جستجو در کاربردهای پزشکی رادیواکتیو ادامه داد. و قدرت تشعشع ترکیبات اورانیم را اندازه گرفت و تحقیق خود را به عناصر دیگر از جمله توریوم ، گسترش داد. ماری و پیر کوری همراه با فیزیک دان فرانسوی هنری بکرل (1908-1852 میلادی) مدل دیوی انجمن سلطنتی انگلستان و جایزه نوبل فیزیک را برای کشف رادیواکتیو دریافت دریافت کردند. پیر کوری کشف کرد که رادیم (Ra) خود به خود حرارت آزاد می کند. این خاصیت، ویژگی اثبات شده ای از انرژی اتمی به شکل گرماست.
برای همین نیز در سال 1910 میلادی در کنفرانس بروکسل در مورد رادیواکتیویته ، واحد رادیواکتیویته به افتخار او کوری نامیده شد. در مورد کشف رادیواکتیویته توسط هانری بکرل باید بگوییم که در سال 1896 میلادی ، بکرل در جستجوی شواهدی بود که ثابت کند مواد شیمیایی که نور طبیعی فلوئورسان دارند، از خود پرتو ساطع می کنند. او یک نمونه سولفات پتاسیم اورانیم را برداشت و آن را همراه با یک صفحه عکاسی در کاغذ سیاه پیچید. از آن جا که روزی ابری بود. نمونه بکرل خاصیت فلوئورسانی را از خود نشان نمی داد. او آن را درکشویی در آزمایشگاه خود گذاشت و به آزمایش های خود در مورد لامپ های اشعه کاتدی ادامه داد.
چند روز بعد، دریافت که نمونه تصویری را بر روی صفحه عکاسی ایجاد کرده است. این نشان می داد که ماده مذکور شکلی از تشعشع را که بعدا ماری کوری آن را رادیواکتیویته نامید، از خود ساطع کرده است. 1922 میلادی نیلز بور نظریه طیف های ساختار اتمی را منتشر کرد و در 1927 میلادی اصل مکمل بودن را تنظیم می کند که رفتار پیچیده رادیواکتیویته را توصیف می کند.  ارنست رادرفورد فیزیکدان بریتانی نیوزلندی الاصل (1871-1937) بر روی رادیواکتیویته و ماهیت ذرات آلفا (دارای بار مثبت) تحقیق کرد و متوجه شد که بار مثبت اتم در مرکز آن و در هسته ای ریز و متراکم متمرکز است. در سال 1930 میلادی رادرفورد تشعشعات مواد رادیواکتیو را منتشر کرد.
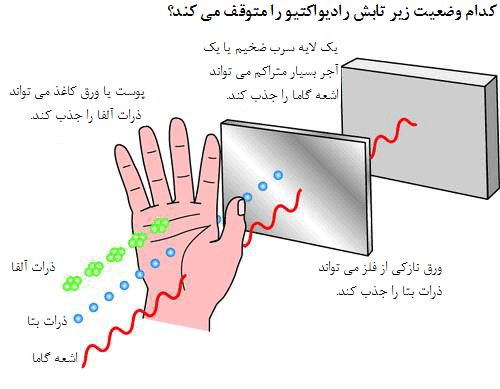
تابش های رادیواکتیو: چنان که گفته شد سه نوع تابش رادیواکتیو وجود دارد که ذرات آلفا از چهار ذره اتمی، یعنی دو پروتون و دو نوترون تشکیل می شوند. این ذرات ضعیف ترین نوع تابش رادیواکتیو هستند، بار الکتریکی مثبت دارند و مسیر آن ها را می توان با صفحه کاغذ مسدود کرد.
ذرات بتا قدرتمندتر از ذرات آلفا هستند و از ذرات اتمی که الکترون نامیده می شوند و بار منفی دارند، تشکیل می شوند. این ذرات از کاغذ عبور می کنند ولی ورقی از آلومینیوم می تواند مسیر آن ها را مسدود کند. پرتوهای گاما از همه قدرتمند ترند. آن ها امواج الکترومغناطیسی اند و فاقد بارالکتریکی اند. این ذرات به قدری پر قدرت اند که فقط لایه ضخیمی از سرب آن ها را متوقف می کند.
  منبع خوب ذرات آلفا، واپاشی آلفا اتم های سنگین (اتم هایی با وزن اتمی بیش تر از 106u) است. وقتی اتمی در واپاشی آلفا ذرات آلفا از خود تابش می کند، عدد جرمی اتم به علت 4 هسته در ذرات آلفا 4 تا کاهش پیدا می کند.
عدد اتمی این اتم در این واپاشی به علت از دست دادن دو پروتون، دو تا کاهش می یابد. بنابراین در این واپاشی یک عنصر جدید به دست می آید. برای مثال در یک تبدیل هسته ای، هنگامی که اورانیوم به توریوم یا رادیوم به رادون تبدیل می شود، واپاشی آلفا رخ می دهد.
 ذرات بتا الکترون ها یا پوزیترون های پر انرژی و پر سرعتی اند که از هسته های رادیواکتیو خاصی مانند پتاسیم - 40 نشر می شوند. دو نوع واپاشی بتا وجود دارد: β− و β+ . در واپاشی β− الکترون نشر می شود و در واپاشی β+ پوزیترون آزاد می شود:   اشعه گاما مانند نور مرئی، اشعه ایکس و یا امواج رادیویی، جزو امواج الکترومغناطیسی است با این تفاوت که پر انرژی تر از این امواج است.
 یک مثال برای واپاشی گاما:
 موضوع مطلب : چهارشنبه 92 مرداد 16 :: 7:0 عصر :: نویسنده : نابغه

کشسان بودن، خاصیتی یک جسم یا ماده است که باعث برگشتن جسم به حالت عادی (قبل از اختلال و اعوجاج) آن می شود. اگر جسم یا ماده به صورت دقیق تری به وضعیت اولیه و اصلی اش باز گردد، کشسان تر خواهد بود.
 یک نوار رزینی (کائوچویی یا پلاستیکی) به راحتی کش می آید و هنگام رها شدن، به حالت اولیه اش برمی گردد؛ اما این نوار به اندازه ی تکه ای از سیم پیانو خاصیت کشسان ندارد.
با این که سیم پیانو به سختی کشیده می شود اما به دلیل بازگشت بهتر به طول عادی اش بعد از کشش، کشسانی تر است. یک رشته پیانوی واقعی می تواند صدها بار بدون کشیده شدن نواخته شود و بعد به مقدار قابل توجه و محسوسی از کوک خارج شود.
 فنر، نمادی از یک جسم کشسان است و هنگام کشیده شدن، یک نیروی بازگرداننده از سوی فنر به نیروی در حال کشش فنر اعمال می شود که تمایل فنر به بازگشت به طول اولیه اش را دارد. این نیروی بازگرداننده معمولا با مقدار کشش متناسب است و با قانون هوک بیان می شود.

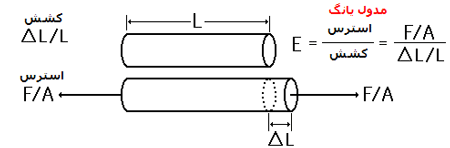
برای سیم ها خاصیت کشسانی معمولا بر اساس مقدار تغییر شکل (کشش) ناشی از استرس یا ضربه توصیف می شود(مدول یانگ).
مدول یانگ: برای توصیف خواص الاستیکی اجسام خطی مانند سیم ها، طناب ها یا ستون ها که هم فشرده و هم متراکم می شوند، یک پارامتر رایج که نسبت استرس(ضربه) به کشش (تغییر طول) است؛ این پارامتر را مدول یانگ می نامند:
خواص کشسانی حالت حجمی (حالت سه بعدی یا بالکی) مواد، عکس العمل مواد به تغییرات ایجاد شده تحت فشار را بیان می کند.
قانون هوک: 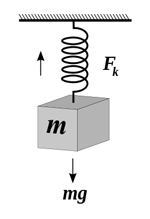
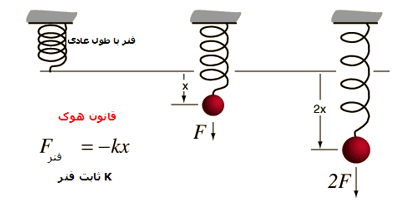
یکی از خاصیت های کشسانی آن است که اگر نیروی کششی وارد بر فنری، دو برابر شود، دو برابر باز می شود. این وابستگی خطی جابه جایی به نیروی کششی، قانون هوک نامیده می شود. علامت منفی در این رابطه به دلیل مخالفت فنر با کشش وارد شده بر آن است.
موضوع مطلب : چهارشنبه 92 مرداد 16 :: 6:59 عصر :: نویسنده : نابغه
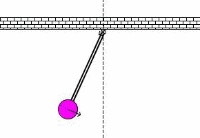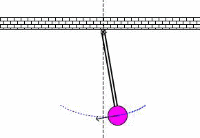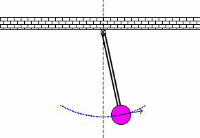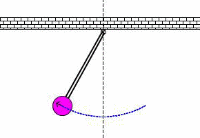
در کاربردهای صوتی، فرکانس تشدیدی، فرکانس معمولی ارتعاشی است که از پارامترهای فیزیکی جسم ارتعاشی تعیین می شود. این نظریه های اساسی فیزیکی که از فرکانس های معمولی تعیین می شوند، در کل محدوده فیزیک مانند مکانیک، الکتریسیته و مغناطیس و حتی در حوزه فیزیک جدید به کار می رود.
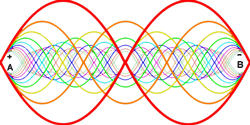 برخی از مفاهیم فرکانس های تشدیدی عبارتند از:
1) بارها اتفاق افتاده است که ببینید، به ارتعاش درآوردن جسمی در فرکانس های تشدیدی اش راحت است اما در فرکانس های دیگر، کار چندان راحتی نیست.
 2) جسم در حال ارتعاش، فرکانس های تشدیدی خود را از یک تحریک پیچیده انتخاب می کند و در آن فرکانس ها به ارتعاش در می آید و به طور کلی، دیگر فرکانس های موجود در تحریک شدن خود را حذف می کند.
3) بیش تر اجسام در حال ارتعاش، چندین فرکانس تشدیدی دارند.
حال به توضیح موارد 1 تا 3 می پردازیم:
سادگی تحریک کردن و ارتعاش جسم به حالت تشدید:
به حرکت تاب در پارک توجه کنید. این حرکت و نوسان مثالی از یک پاندول است؛ یعنی یک سیستم تشدیدی که تنها یک فرکانس تشدیدی دارد. یک هل کوچک به تاب، باعث می شود که هر بار تاب به سمت شما برگردد؛ شما می توانید به این کار ادامه دهید تا دامنه تاب را بالا ببرید.
 اگر سعی کنید که دوبرابر قبل در این فرکانس، به تاب نیرو وارد کنید، خواهید دید که این کار خیلی سخت است و حتی ممکن است دندان هایتان را هم از دست دهید!!!
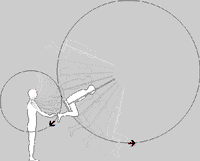 
انتخاب فرکانس های تشدیدی توسط جسم مرتعش: در بالا اشاره شد که جسم مرتعش با فیلتر کردن فرکانس های دیگر در حالت تحریک شده خود، فرکانس های تشدیدی را انتخاب می کند. 
اگر به جسمی که به فنر متصل شده است، به یک تکه چوب ضربه بزنید، حرکت اولیه آن ممکن است پیچیده باشد؛ اما تشدید اصلی در فرکانس عادی و طبیعی خود در ضربه به سمت بالا یا پایین اتفاق می افتد. ضربه سبک با چوب یک تحریک پیچیده با مؤلفه های فرکانسی زیاد است اما همچنان فنر فرکانس طبیعی خود را انتخاب کرده و به آن پاسخ می دهد.
موضوع مطلب : چهارشنبه 92 مرداد 16 :: 6:56 عصر :: نویسنده : نابغه
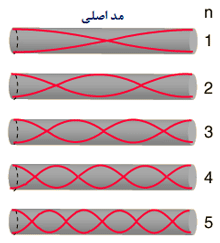
حالت اصلی ارتعاشی یک طناب کشیده شده طبق رابطه L=λ/2 به صورت دو برابر بودن طول موج نسبت به طول طناب تعریف می شود:
 با استفاده از روابط پایه ای در فیزیک می توان رابطه سرعت موج، طول موج و فرکانس را به دست آورد:
 رابطه x=vt را به خاطر آورید. اگر طول موج را هم به صورت یک حالت خاص فاصله در فضا در نظر بگیرید، خواهیم داشت:
λ = vT
که زمان لازم برای انجام کامل یک نوسان را با T نشان داده ایم. حال با استفاده از رابطه f=1/T رابطه استاندارد امواج را به دست می آوریم:
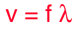 این یک رابطه ی عمومی در امواج است که برای امواج صوتی و نوری و سایر امواج الکترومغناطیسی و امواج واقع در محیط مکانیکی به کار می رود.
با استفاده از رابطه اخیر و L=λ/2 داریم: 
از آن جایی که سرعت موج با رابطه
 داده می شود، فرکانس موج خواهد بود:
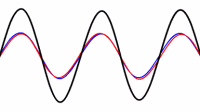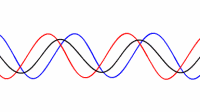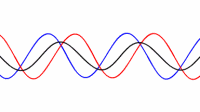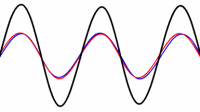
 طناب در تمام هارمونیک های اصلی ارتعاش خواهد داشت. هر کدام از این هارمونیک ها یک موج ایستاده روی طناب تشکیل خواهند داد:
 این تصویر یک موج ایستاده تشدیدی روی طناب را نشان می دهد. توسط یک ارتعاش کننده در 120 هرتز می توان این موج را تولید کرد.
هارمونیک ها:در بالا اشاره شد که یک طناب ایده آل مرتعش با فرمانس اصلی و تمام هارمونیک های آن فرکانس ارتعاش خواهد کرد. مکان گره ها و شکم ها دقیقا مخالف حالت ستون هوا خواهد بود:
و هارمونیک ها مضرب های صحیحی هستند. موضوع مطلب : |
||||||||
نویسندگان
پیوندها
آخرین مطالب
|
||||||||





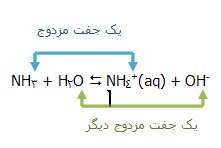

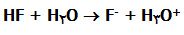 کدام اشتباه است؟
کدام اشتباه است؟
 ) نشان داده می شوند و این فلش به معنای
) نشان داده می شوند و این فلش به معنای  ) باشند که نماد
) باشند که نماد 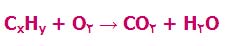
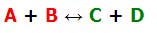
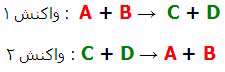
 را مشاهده می کنیم.
را مشاهده می کنیم.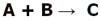 برگشت پذیر نیست زیرا با فلش یک طرفه نشان داده شده است.
برگشت پذیر نیست زیرا با فلش یک طرفه نشان داده شده است.